ГЕНЕТИЧЕСКИЕ ПРЕДИКТОРЫ РАЗВИТИЯ ПАРОДОНТИТА: ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ (ОБЗОР ЛИТЕРАТУРЫ)
Нет в наличии
Описание
АННОТАЦИЯ
Актуальность. На сегодняшний день ведутся активные исследования по поиску генетических маркеров пародонтита, обнаружение которых позволит выявлять пациентов группы риска задолго до появления первых признаков заболевания, прогнозировать течение болезни и интенсивно проводить профилактические мероприятия, направленные на устранение негативных факторов окружающей среды.
Цель – систематизация имеющихся данных по изучению ассоциации генов с развитием агрессивного и хронического генерализованного пародонтита.
Материалы и методы. С помощью поисковых систем PubMed, Google Search и eLIBRARY было найдено 214 публикаций, опубликованных с 2005 по 2020 год. Было отобрано 135 публикаций, среди которых встречались клинические исследования и данные метаанализа.
Результаты. Такие хронические воспалительные заболевания, как пародонтит, являются типично полигенными, а ассоциированные с подобными заболеваниями гены рассматриваются как гены предрасположенности. Наличие связанного с заболеванием аллеля у индивидуума не является абсолютным диагностическим признаком для развития заболевания, однако отражает риск его развития. При поиске генетических маркеров пародонтита ключевая роль отводится тем генам, которые кодируют белки, имеющие важные роли на разных этапах патогенеза воспалительных заболеваний пародонта. Среди них: дефензины, интерлейкины, Толл-подобные рецепторы, α1-цепь коллагена I типа и другие. На сегодняшний день изучено порядка 300 полиморфизмов и обнаружена ассоциация некоторых из них с развитием пародонтита.
Заключение. Точный генетический маркер пародонтита на данный момент неизвестен. Дальнейший поиск генов-кандидатов должен проходить параллельно с расширением знаний о патогенезе воспалительных заболеваний пародонта. Определение пресимптоматической предрасположенности к болезни позволит повысить качество оказания стоматологической помощи и проведения профилактических мероприятий еще до появления клинических признаков.
Ключевые слова: генетический полиморфизм, генетический предиктор, пародонтит, предрасположенность к ВЗП.
АКТУАЛЬНОСТЬ
Распространенность воспалительных заболеваний пародонта (ВЗП) в процентном отношении достигла таких масштабов, что по статистическим критериям они подходят под понятие эпидемии. Согласно эпидемиологическим данным ВОЗ, около 80% детского населения и 95% взрослого населения планеты имеют те или иные признаки заболевания тканей, окружающих и удерживающих зуб в альвеоле, при этом самым распространенным признаком заболевания является кровоточивость десен [1, 2]. Кроме роста распространенности ВЗП, отмечается устойчивая тенденция к росту тяжелых форм воспалительных заболеваний пародонта во всех возрастных группах. В России за последние годы отчетливо ощущается тенденция к снижению возраста пациентов с генерализованными формами воспалительных заболеваний пародонта [3].
Как известно, причиной развития ВЗП является наличие сложных комплексов пародонтопатогенов, которые колонизируют поверхность зуба и участвуют в формировании зубного налета [4]. Однако только присутствия бактерий недостаточно для развития пародонтита. Данное заболевание является многофакторным, в патогенезе которого большее значение имеет иммунный ответ макроорганизма на бактериальное воздействие, наличие общесоматической патологии, а также таких предрасполагающих факторов риска, как курение, плохая гигиена полости рта, стресс [2, 5, 6]. Кроме того, по крайней мере в 50% случаев восприимчивость к воспалительным заболеваниям пародонта определяется наследственностью [7]. Такие хронические воспалительные заболевания, как пародонтит, являются типично полигенными, а ассоциированные с подобными заболеваниями гены рассматриваются как гены предрасположенности. Характер течения пародонтита в каждом клиническом случае определяется индивидуальными особенностями организма человека, которые обуславливают его восприимчивость к развитию болезни. Предполагается, что по меньшей мере 20 генов могут быть связаны с предрасположенностью к пародонтиту, но какие именно гены и в каком количестве – нужно определять в каждом конкретном клиническом случае [8].
Целью данного обзора является систематизация имеющихся данных в отношении поиска генов предрасположенности к агрессивному и хроническому генерализованному пародонтиту.
ПОНЯТИЕ О SNP И МУЛЬТИФАКТОРИАЛЬНЫХ ЗАБОЛЕВАНИЯХ
Большинство заболеваний человека в своей этиологии имеет генетический компонент, однако степень его участия может сильно различаться. Изменения в генах, так называемые поломки, мутации, являющиеся одним из видов биоразнообразия, называются генетическим полиморфизмом. Подобные изменения могут быть результатом спонтанных случайных процессов или могут быть индуцированы воздействием внешних факторов (например, вирусов или излучением). Замена одного нуклеотида (SNP) является наиболее распространенной формой генетического полиморфизма в геноме человека [9]. Многие SNPs широко распространены среди индивидуумов одной популяции.
Полиэтиологические (многофакторные) хронические воспалительные заболевания, такие как пародонтит, являются результатом совокупного влияния на ткани отдельных уникальных генетических последовательностей и факторов окружающей среды (например, диета, стресс, микробные агенты), которые играют важную роль в проявлении дефектных свойств продуктов генов, вовлеченных в предрасположенность к заболеванию [9]. Итогом такого взаимодействия является появление фактического состояния болезни. Взаимосвязи между всеми факторами настолько сложны, что чрезвычайно трудно количественно определить конкретный вклад каждого компонента в развитие заболевания. Кроме того, для большинства хронических состояний требуется много лет, чтобы проявились клинические признаки [7].
В отличие от хромосомных мутаций, которые могут устранить генный продукт или изменить белковый продукт гена настолько, что это значительно повлияет на работу биологических процессов, отдельные точечные мутации обычно работают в пределах нормального диапазона функций и долгое время могут никак не проявлять себя [7]. Генетические полиморфизмы, ассоциированные с полиэтиологическими заболеваниями, такими как пародонтит, часто не напрямую с ними связаны и не являются определяющим фактором в проявлении клинических признаков в большинстве случаев. Они в значительной мере отражают лишь риск развития болезни [7, 8]. Важно понимать, что аллели, ассоциированные с заболеванием, также найдены у здоровых людей (но реже, чем у больных), а некоторые пациенты с болезнью не имеют аллеля, связанного с заболеванием. Кроме того, стоит отметить, что многофакторные заболевания появляются не из-за дефекта одного гена, в их этиологии участвуют генетические варианты сразу нескольких локусов хромосом, что ведет к их сочетанному влиянию.
Таким образом, наличие связанного с заболеванием аллеля у индивидуума не является абсолютным диагностическим признаком для развития заболевания, а знание о присутствии одной аллели у индивидуума, связанной с заболеванием, не является достаточной информацией для постановки клинического диагноза. Корреляция между генетическим полиморфизмом и клиническими проявлениями болезни, как правило, гораздо слабее, чем между хромосомными мутациями и болезнью (фенотипом) [7]. Тем не менее, измененные функции белков в различных структурных и иммунных путях показывают, что даже точечные генетические изменения различных генов при определенных условиях могут влиять на клеточные реакции, повышая тем самым восприимчивость организма к негативному воздействию окружающих факторов, что ведет к появлению патологических изменений в тканях пародонта. При этом экспрессия генов в различных тканях может варьироваться [7]. При изменении нуклеотида в последовательности ДНК продукт (белок), кодируемый геном, либо остается прежним, либо меняется его структура (за счет изменения аминокислоты) и функция, либо меняется продукция данного белка, что также отражается на течении биологических процессов. Если функции белка изменены в биологическом процессе, например при воспалительном ответе на конкретный микробный агент, определенные полиморфизмы могут увеличивать или уменьшать риск прогрессирования болезни для человека [10].
Важно иметь информацию о частоте аллелей в тестируемой популяции, а также иметь возможность количественно оценить величину эффекта ассоциированного с заболеванием аллеля на патологические процессы, то есть во сколько раз присутствие данного SNP повышает риск развития заболевания.
Измерение чувствительности и специфичности аллеля важно для расчета вероятности развития заболевания. Для этого применяют популяционный подход обнаружения ассоциированного с болезнью аллеля, основанный на стандартной схеме «случайконтроль» [7]. При этом частоты аллелей изучаемых SNP сравниваются между группой пациентов с фенотипическими проявлениями заболевания и группой контроля (клинически здоровыми людьми или отдельными лицами, случайно выбранными из населения). Частоты полиморфизмов генов-кандидатов, чьи белковые продукты играют важную роль в иммунной реакции, могут быть сопоставлены между исследуемой и контрольной группами. Значимые различия в частоте конкретных полиморфизмов между этими двумя группами свидетельствуют о том, что ген-кандидат имеет значение в определении предрасположенности к болезни [7]. Если связь аллеля с заболеванием найдена, то возможны несколько интерпретаций полученного результата [10]:
1. Ассоциированный аллель является или, наоборот, не является болезнь-предрасполагающим аллелем.
2. Ассоциированный аллель находится в неравновесном сцеплении с фактическим локусом, предрасполагающим к болезни.
3. Ассоциация обусловлена особенностями выборки, обусловленной делением по расе, этнической принадлежности, полу и т.д.
4. Ассоциация является артефактом (возможно, статистическим).
Таким образом, описанный популяционный метод может помочь выяснить патогенез заболеваний, выявить причинно-следственные связи и, в конечном итоге, выявить лиц, наиболее подверженных риску заболевания.
Изученные гены предрасположенности к пародонтиту
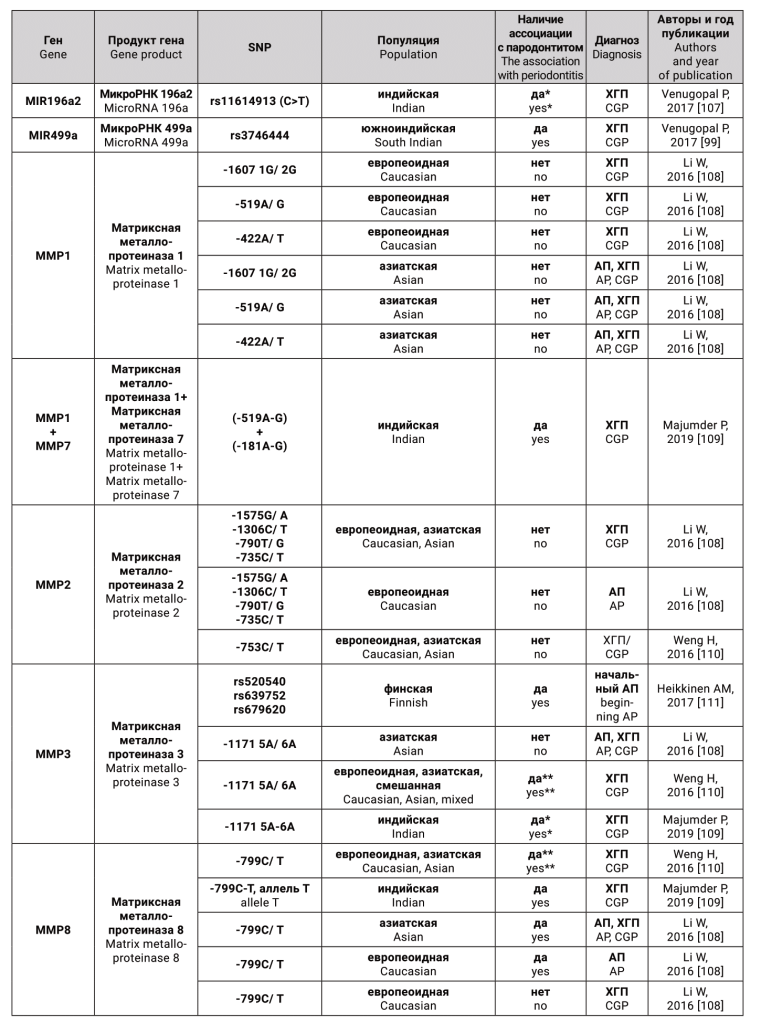
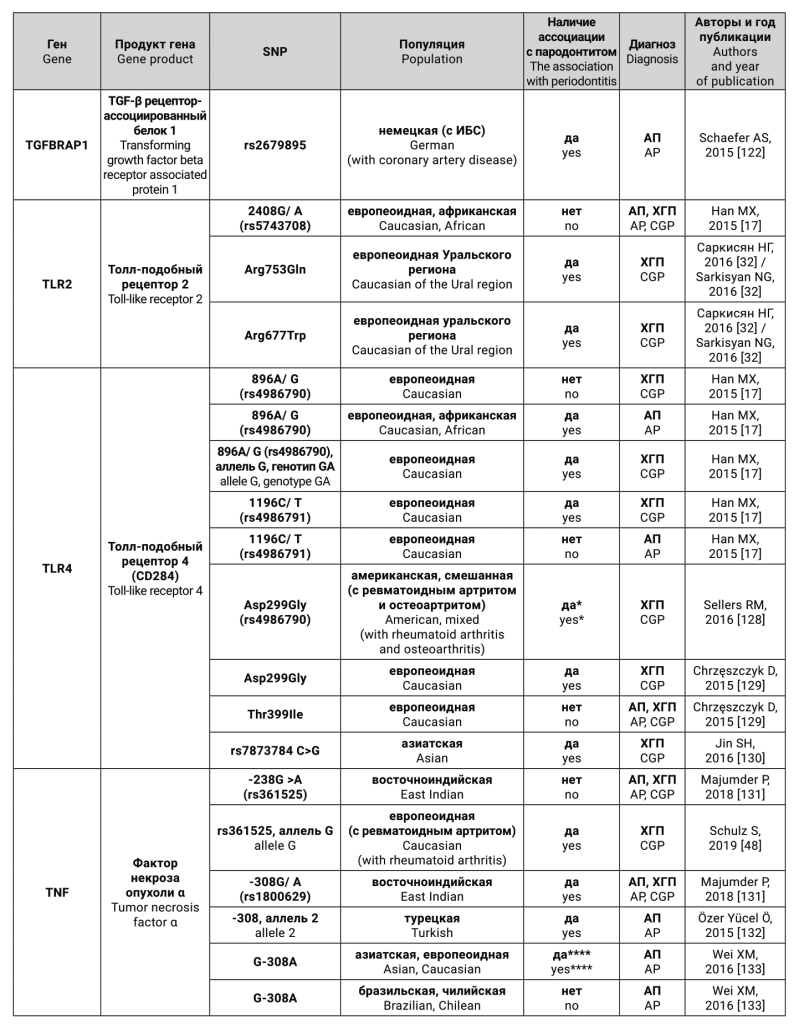
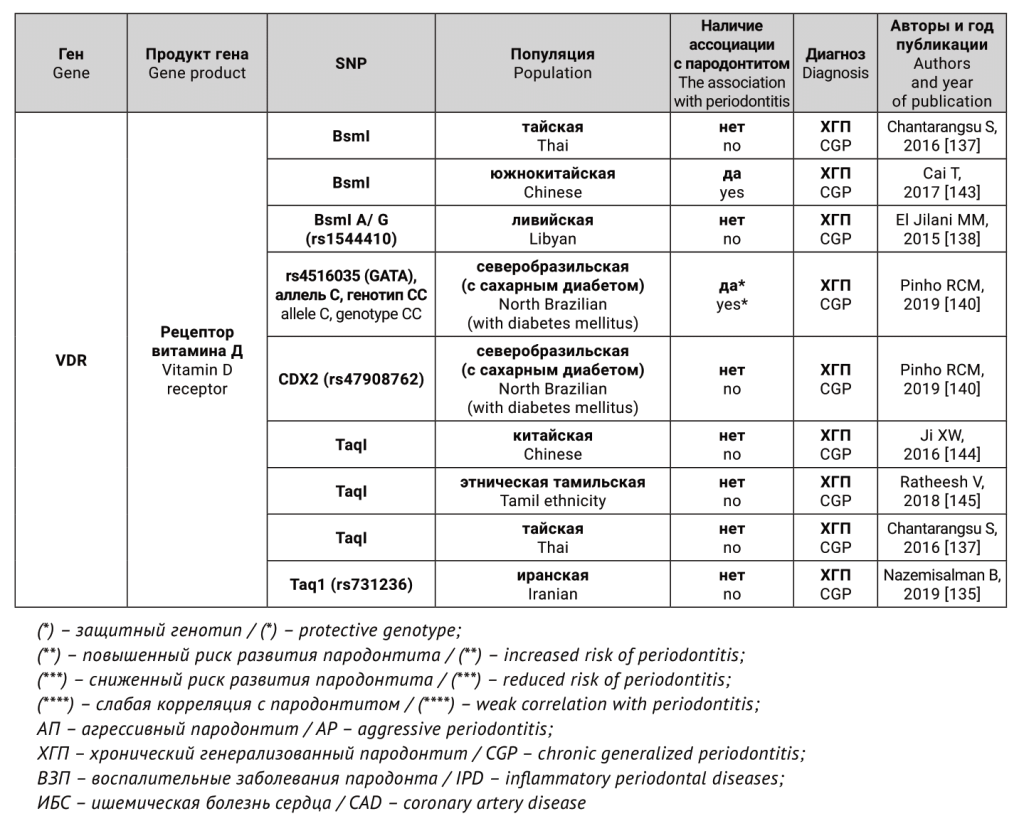
Гены-кандидаты и соответствующие им белки, для которых были исследованы генные полиморфизмы, как предполагаемые факторы риска для агрессивного и хронического генерализованного пародонтита, представлены в таблице.
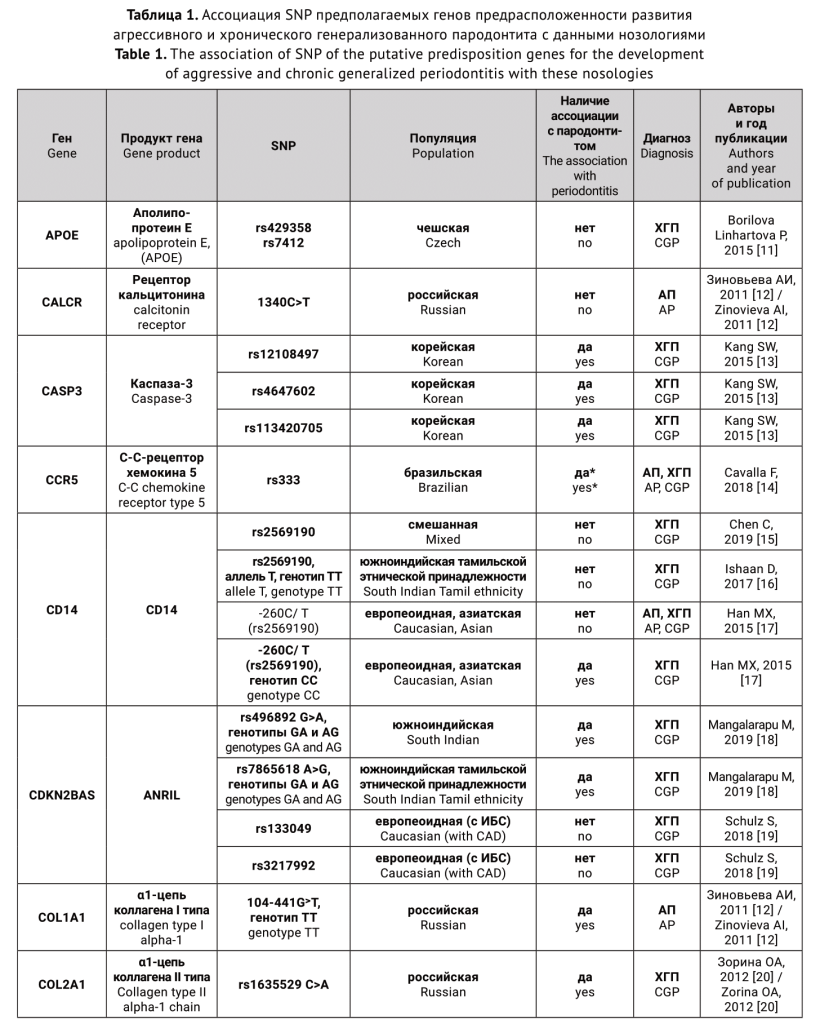
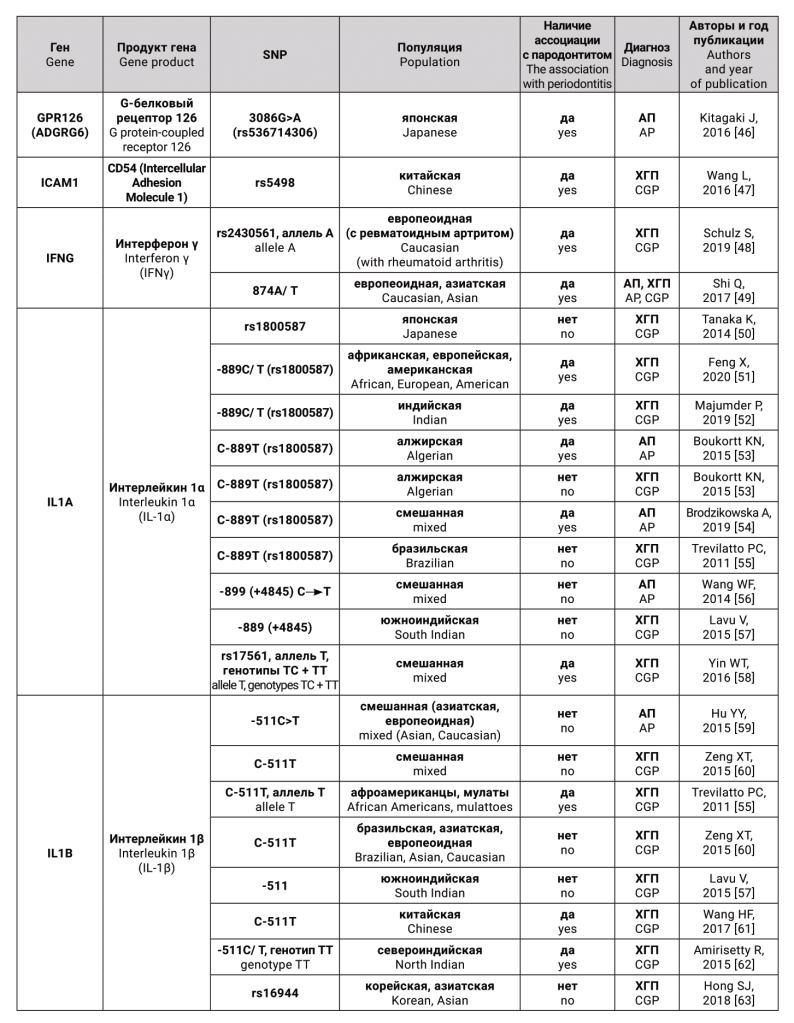
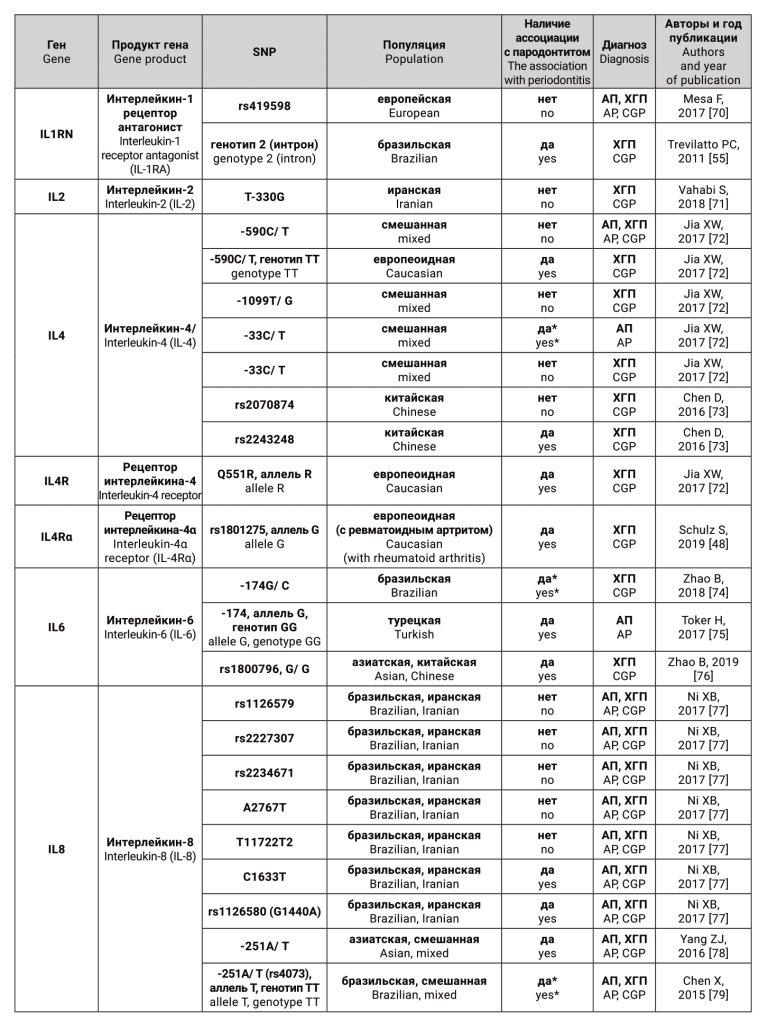
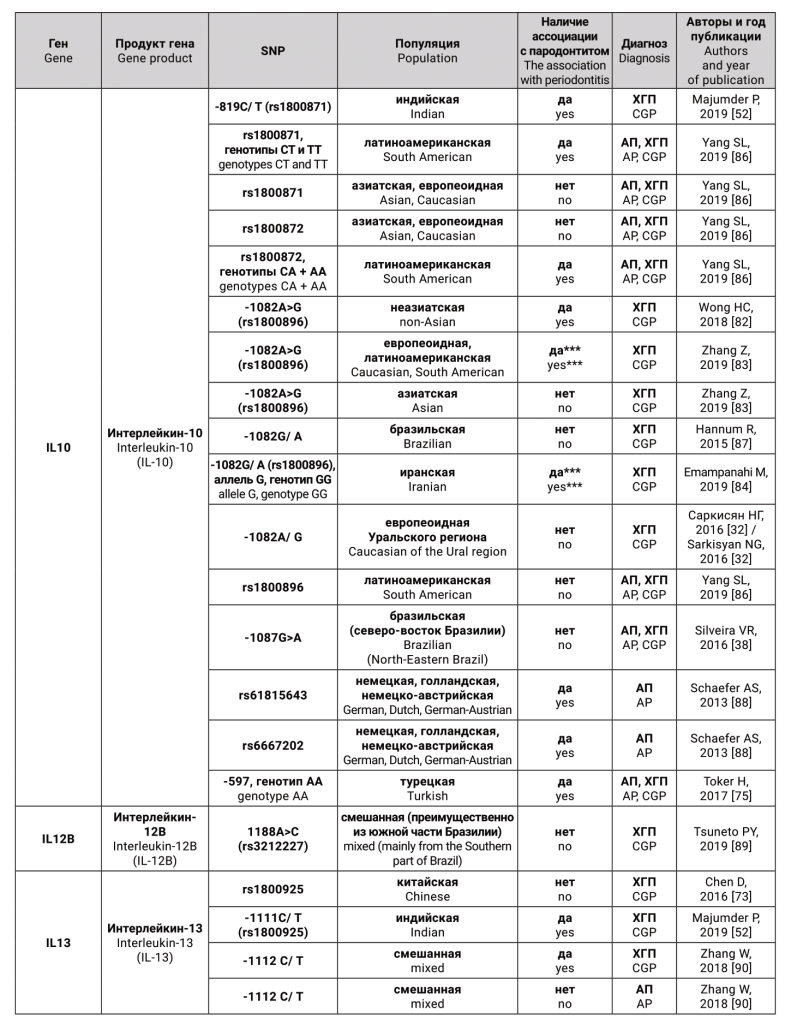
ОБСУЖДЕНИЕ
Таким образом, на сегодняшний день существует около 307 «пародонтит связанных» генов человека [146]. Тем не менее, ни один из них не оказался существенным диагностическим или прогностическим маркером для выявления пациентов, которые подвергаются риску появления тяжелых форм пародонтита [7]. Это происходит потому, что, во-первых, как уже было сказано выше, важное значение для исследования генов, ассоциированных с болезнью, имеет тот факт, является ли заболевание моногенным или мультифакториальным. Гораздо сложнее выявить и строго продемонстрировать этиологическую роль конкретных генов в мультифакториальных нозологиях. В отличие от моногенных заболеваний, которые могут быть вызваны одной мутацией, суммарный эффект множественных генов является определяющим в восприимчивости к болезни в таких комплексных заболеваниях, как хронический пародонтит [7]. Во-вторых, при поиске генов предрасположенности может оказаться, что на риск развития пародонтита одномоментно оказывает влияние большое количество SNP, обнаружение и изучение каждого из которых займет немало времени. Стоит учитывать, что в ходе исследования также могут быть получены ложноположительные результаты, поэтому для обнаружения значимой связи генов с болезнью популяционные исследования желательно проводить на больших выборках не менее 1000 человек. В-третьих, сложности возникают из-за высокой этнической неоднородности изучаемой популяции. И, наконец, исследователи нередко сталкиваются с проблемой отсутствия четких критериев дифференциации нозологических форм ВЗП при постановке диагноза вследствие проведения нестандартизованных научных исследований.
Кроме того, большая часть генетических исследований была сосредоточена на изучении полиморфизмов генов белков, которые участвуют в клеточном и гуморальном иммунитете или метаболизме, таких как цитокины, рецепторы распознавания антигена, рецепторы клеточной поверхности, ферменты и прочее. Однако стоит учитывать, что цитокины участвуют не только в воспалительных реакциях полости рта, а имеют много других функций в организме, участвуют в системных реакциях. Так, например, цитокины ИЛ-1, ФНО-α, ИЛ-8 не только играют центральную роль в регуляции иммунных и воспалительных реакций организма на инфекции, но и опосредуют межклеточные взаимодействия при кроветворении, участвуют в межсистемных коммуникациях. ИЛ-1 и ФНО-α опосредуют общие гематологические сдвиги, характерные для ответа макроорганизма на инфекцию (лихорадка, уменьшение массы тела, синтез острофазных белков, увеличение проницаемости сосудов). ИЛ-1 обеспечивает взаимосвязь иммунной, нервной и эндокринной систем. В свою очередь ИЛ-8 стимулирует ангиогенез, а ИЛ-10 угнетает продукцию провоспалительных цитокинов. Поскольку их роль в качестве цитокинов и регуляторов воспаления является настолько многогранной, то любое изменение биологического баланса между агонистическими и антагонистическими сигналами может вызвать заболевание. Поэтому логично, что мутации в генах этих цитокинов, скорее всего, будут приводить к развитию системных заболеваний, и их проявления не ограничатся только полостью рта. В связи с этим мы предполагаем, что нужно изучать мутации в генах белков первой линии защиты эпителия полости рта. Это позволит выявить наличие дефектов в белках первой линии защиты и понять, почему прорывается этот барьер.
ЗАКЛЮЧЕНИЕ
Мы вступаем в эру персонифицированной медицины и несмотря на все имеющиеся трудности поиск генетических маркеров является актуальным. Генетические исследования могут привести к пониманию факторов, опосредующих иммунный ответ, что может объяснить, почему этот ответ часто заметно отличается у людей со схожим экологическим фоном и сопоставимыми привычками образа жизни. На фундаментальном уровне персонифицированная медицина может быть определена как принятие решения о методе лечения заболевания человека, основанное на вероятностях событий, данных взаимодействия между генетическими, клиническими особенностями и факторами окружающей среды, затрагивающими конкретного человека [146]. Применений знаний о генетическом профиле человека в стоматологии позволит повысить качество оказания медицинской помощи, проведения профилактических мероприятий, инновационной диагностики и терапии, сделает возможным идентификацию пресимптоматической предрасположенности к болезни, а также позволит создать новые биоматериалы для восстановления структур полости рта и зубов [9]. В случаях, когда существует высокая генетическая вероятность заболевания, могут быть приняты интенсивные меры профилактики до развития типичной болезни, направленные на устранение факторов окружающей среды, вызывающих болезнь [5]. Для того чтобы применить эти потенциальные новые знания о роли генов для улучшения лечения и профилактики заболеваний пародонта, мы должны не только уметь идентифицировать генетические детерминанты, но и знать, как безопасно контролировать или модулировать реакцию хозяина, вызывая желаемый иммунный ответ, или даже блокировать прогрессирование заболевания за счет отключения факторов, активирующих резорбцию кости [7].
СПИСОК ЛИТЕРАТУРЫ
1. World Health Organization. Regional office for Europe. Data and statistics. Available from: https://www.euro.who.int/en/health-topics/diseaseprevention/oral-health/data-and-statistics
2. Nazir MA. Prevalence of periodontal disease, its association with systemic diseases and prevention. International Journal of Health Sciences. 2017;11(2):72-80. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5426403/
3. Кузьмина ЭМ. Стоматологическая заболеваемость населения России / Кузьмина ЭМ, Янушевич ОО, Кузьмина ИН. – М.: Авторский тираж, 2019. – 304 с. Kuzmina EM. Dental morbidity of the population of Russia / Kuzmina EM, Yanushevich OO, Kuzmina IN. – M.: Author's edition, 2019. – 304 p.
4. Holt SC, Ebersole JL. Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the «red complex», a prototype polybacterial pathogenic consortium in periodontitis. Periodontology 2000. 2005;38(1):72-122. doi: 10.1111/j.1600-0757.2005.00113.x.
5. Bali D, Pandit N, Kathuria R, Bali A. Genetics and Aggressive Periodontal Disease: An Update Review. Journal of Oral Health and Community Dentistry. 2012;6(2):97-101. doi: 10.5005/johcd-6-2-97
6. Indriolo A, Greco S, Ravelli P, Fagiuoli S. What can we learn about biofilm/host interactions from the study of inflammatory bowel disease. Journal of Clinical Periodontology. 2011;38:36-43. doi: 10.1111/j.1600-051X.2010.01680.x.
7. Taba MJ, Souza SLS de, Mariguela VC. Periodontal disease: a genetic perspective. Brazilian Oral Research. 2012;26(1):32-38. doi: 10.1590/s1806-83242012000700006
8. Toy VE, Uslu MO. Do genetic polymorphisms affect susceptibility to periodontal disease? A literature review. Nigerian Journal of Clinical Practice. 2019;22(4):445-453. doi: 10.4103/njcp.njcp_462_18.
9. Gupta K.K., P. Tondon SK. Role of human genes on the periodontium. E-Journal of Dentistry. 2012; 2(3): 187-192. Available from: https://www.oalib.com/paper/2778198#.YT-XOk5R1PZ
10. Kinane D, Hart T. Genes and gene polymorphisms associated with periodontal disease. Critical reviews in oral biology and medicine: an official publication of the american association of oral biologists. 2003;14:430-449. doi: 10.1177/154411130301400605
11. Borilova Linhartova P, Bartova J, Poskerova H, Machal J, Vokurka J, Fassmann A, et al. Apolipoprotein E gene polymorphisms in relation to chronic periodontitis, periodontopathic bacteria, and lipid levels. Archives of Oral Biology. 2015;60(3):456-462. doi:10.1016/j.archoralbio.2014.10.003
12. Зиновьева АИ, Атрушкевич ВГ, Поляков АВ, Щагина ОА. Генетические параллели в мультифакторных моделях пародонтита с агрессивным течением и остеопороза. Российская стоматология. 2011;4(6):34-40. Режим доступа: https://www.mediasphera.ru/issues/rossijskaya-stomatologiya/2011/6/032072-6406201168 Zinovieva AI, Atrushkevich VG, Polyakov AB, Shchagina OA. Genetic parallels in multifactorial models of aggressive periodontitis and osteoporosis. Russian dentistry. 2011;4(6):34-40. Available from: https://www.mediasphera.ru/issues/rossijskaya-stomatologiya/2011/6/032072-6406201168
13. Kang SW, Kim SK, Chung JH, Ban JY. Assessment of CASP gene polymorphisms in periodontal disease. Genetics and Molecular Research: GMR. 2015;14(4):18069-18077. doi:10.4238/2015.December.22.33
14. Cavalla F, Biguetti CC, Dionisio TJ, Azevedo MCS, Martins WJ, Santos CF, et al. CCR5Δ32 (rs333) polymorphism is associated with decreased risk of chronic and aggressive periodontitis: A case-control analysis based in disease resistance and susceptibility phenotypes. Cytokine. 2018;103:142-149. doi: 10.1016/j.cyto.2017.09.022
15. Chen C, Fan X, Yu S, Liu P, Pan Y, Lin L, et al. Association between periodontitis and gene polymorphisms of HBD-1 and СD14: a meta-analysis. Archives of Oral Biology. 2019;104:141-149. doi: 10.1016/j.archoralbio.2019.05.029
16. Ishaan D, Parthasarathy H, Ponnaiyan D, Tadepalli A. The CD14 rs2569190 TT genotype is associated with chronic periodontitis. Genetic Testing and Molecular Biomarkers. 2017;21(9):560-564. doi: 10.1089/gtmb.2017.0029
17. Han M xuan, Ding C, Kyung HM. Genetic polymorphisms in pattern recognition receptors and risk of periodontitis: Evidence based on 12,793 subjects. Human Immunology. 2015;76(7):496-504. doi: 10.1016/j.humimm.2015.06.006
18. Mangalarapu M, Vinukonda S, Komaravalli P, Nagula P, Koduganti R, Korripally P, et al. Association of CDKN2BAS gene polymorphism with periodontitis and coronary artery disease from South Indian population. Gene. 2019;710. doi: 10.1016/j.gene.2019.06.002
19. Schulz S, Seitter L, Werdan K, Hofmann B, Schaller HG, Schlitt A, et al. Single nucleotide polymorphisms in long noncoding RNA, ANRIL, are not associated with severe periodontitis but with adverse cardiovascular events among patients with cardiovascular disease. Journal of Periodontal Research. 2018;53(5):714-720. doi: 10.1111/jre.12555
20. Зорина ОА, Борискина ОА. Взаимосвязь полиморфизма генов некоторых коллагенов с развитием заболеваний пародонта. The Scientific & Educational Bulletin «Health & Educational Millennium». 2012;14(5):1-3. Режим доступа: https://cyberleninka.ru/article/n/vzaimosvyaz-polimorfizma-genov-nekotoryh-kollagenov-s-razvitiemzab... Zorina OA, Boriskina OA. The relationship of gene polymorphism of some collagens with the development of periodontal diseases. The Scientific & Educational Bulletin „Health & Educational Millennium”. 2012;14(5):1-3. Available from: https://cyberleninka.ru/article/n/vzaimosvyaz-polimorfizma-genov-nekotoryh-kollagenov-s-razvitiemzab...
21. Zhang ZS. Association between COX2 -765G/C polymorphism and periodontitis in Chinese population: a meta-analysis. BMC Oral Health. 2018;18(1):32. doi: 10.1186/s12903-018-0483-9
22. Jiang L, Weng H, Chen MY, Zhang C, Zeng XT. Association between cyclooxygenase-2 gene polymorphisms and risk of periodontitis: a meta-analysis involving 5653 individuals. Molecular Biology Reports. 2014;41(7):4795-4801. doi: 10.1007/s11033-014-3350-z
23. Prakash G, Umar M, Ajay S, Bali D, Upadhyay R, Gupta KK, et al. COX-2 gene polymorphisms and risk of chronic periodontitis: a case-control study and metaanalysis. Oral Diseases. 2015;21(1):38-45. doi: 10.1111/odi.12203
24. Selvaraj SM, Christina JJ, Gurumoorthy S, Jayaraman BG, Vellaichamy A. Association of - 757T > C polymorphism of C-reactive protein gene with chronic periodontitis of South Indian population. Inflammation Research: Official Journal of the European Histamine Research Society. 2019;68(5):347-349. doi: 10.1007/s00011-019-01230-2
25. He F, Zhou Y, Wang X, Li L, Geng Y, Wang Z, et al. Functional Polymorphisms of CTLA4 associated with aggressive periodontitis in the Chinese Han Population. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology. 2018;50(3):1178-1185. doi: 10.1159/000494544
26. Grdović N, Rajić J, Petrović SM, Dinić S, Uskoković A, Mihailović M, et al. Association of CXCL12 gene promoter methylation with periodontitis in patients with diabetes mellitus type 2. Archives of Oral Biology. 2016;72:124-133. doi:10.1016/j.archoralbio.2016.08.025
27. Kavrikova D, Borilova Linhartova P, Lucanova S, Poskerova H, Fassmann A, Izakovicova Holla L. Chemokine Receptor 2 (CXCR2) Gene Variants and Their Association with Periodontal Bacteria in Patients with Chronic Periodontitis. Mediators of Infammation. 2019;2019:2061868. doi:10.1155/2019/2061868
28. Teumer A, Holtfreter B, Völker U, Petersmann A, Nauck M, Biffar R, et al. Genome-wide association study of chronic periodontitis in a general German population. Journal of Clinical Periodontology. 2013;40(11):977-985. doi: 10.1111/jcpe.12154
29. Munz M, Willenborg C, Richter GM, JockelSchneider Y, Graetz C, Staufenbiel I, et al. A genomewide association study identifies nucleotide variants at SIGLEC5 and DEFA1A3 as risk loci for periodontitis. Human Molecular Genetics. 2017;26(13):2577-2588. doi:10.1093/hmg/ddx151
30. Zupin L, Robino A, Navarra CO, Pirastu N, Di Lenarda R, Gasparini P, et al. LTF and DEFB1 polymorphisms are associated with susceptibility toward chronic periodontitis development. Oral Diseases. 2017;23(7):1001-1008. doi:10.1111/odi.12689
31. Soraia Aguiar de Melo Dias R, Carlos Mourão Pinho R, Almeida FR de, Alfredo Farias Bandeira F, Celerino da Silva R, Crovella S, et al. Evaluation of DEFB1 polymorphisms in individuals with chronic periodontitis and diabetes mellitus type 2 in a population of northeastern Brazil. Special Care in Dentistry: Official Publication of the American Association of Hospital Dentists, the Academy of Dentistry for the Handicapped, and the American Society for Geriatric Dentistry. 2018;38(4):227-233. doi: 10.1111/scd.12296
32. Саркисян НГ, Ганковская ЛВ, Тузанкина ИА, Свитич ОА, Ронь ГИ, Шершнев ВН и др. Ассоциация полиморфных маркеров в генах врожденного иммунитета у больных пародонтитом и воспалительными заболеваниями верхних дыхательных путей. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016(1):67-71. Режим доступа: https://cyberleninka.ru/article/n/assotsiatsiya-polimorfnyh-markerov-v-genah-vrozhdennogo-immuniteta... Sarkisyan NG, Gankovskaya LV, Tuzankina IA, Svitich OA, Ron GI, Shershnev VN, etc. Association of polymorphic markers in the genes of innate immunity in patients with periodontitis and infammatory diseases of the upper respiratory tract. Journal of Microbiology, Epidemiology and Immunobiology. 2016(1):67-71. Available from: https://cyberleninka.ru/article/n/assotsiatsiya-polimorfnyh-markerov-v-genah-vrozhdennogo-immuniteta...
33. Shao J, Zhang M, Wu L, Jia XW, Jin YH, Zeng XT. DEFB1 rs11362 polymorphism and risk of chronic periodontitis: a meta-analysis of unadjusted and adjusted data. Frontiers in Genetics. 2019;10:179. doi: 10.3389/fgene.2019.00179
34. Ma X, Li H, Chou H. Correlation of DEFB1 polymorphisms with chronic periodontitis in Henan Han population. Chinese journal of medical genetics. 2019;36(4):371-375. doi:10.3760/cma.j.issn.1003-9406.2019.04.020
35. Ikuta T, Inagaki Y, Tanaka K, Saito T, Nakajima Y, Bando M, et al. Gene polymorphism of β-defensin-1 is associated with susceptibility to periodontitis in Japanese. Odontology. 2015;103(1):66-74. doi: 10.1007/s10266-013-0139-9
36. Kurt-Bayrakdar S, Ozturk A, Kara N. DEFB4A promoter polymorphism is associated with chronic periodontitis: a case-control study. Genetic Testing and Molecular Biomarkers. 2020;24(3):113-119. doi: 10.1089/gtmb.2019.0218
37. Bevilacqua L, Navarra CO, Pirastu N, Lenarda R Di, Gasparini P, Robino A. A genome-wide association study identifes an association between variants in EFCAB4B gene and periodontal disease in an Italian isolated population. Journal of Periodontal Research. 2018;53(6):992-998. doi:10.1111/jre.12598
38. Silveira VRS, Pigossi SC, Scarel-Caminaga RM, Cirelli JA, Rêgo R, Nogueira NAP. Analysis of polymorphisms in Interleukin 10, NOS2A, and ESR2 genes in chronic and aggressive periodontitis. Brazilian Oral Research. 2016; 30(1):e105. doi: 10.1590/1807-3107BOR-2016.vol30.0105
39. Weng H, Zhang C, Hu YY, Yuan RX, Zuo HX, Yan JZ, et al. Association between estrogen receptor-α gene XbaI and PvuII polymorphisms and periodontitis susceptibility: a meta-analysis. Disease Markers. 2015;2015:741972. doi: 10.1155/2015/741972
40. Song W li, Tian Y, Wang X e, Zhang L, Xu L, Shi D, et al. Association between FADS1 rs174537 polymorphism and serum proteins in patients with aggressive periodontitis. Journal of Peking University Health sciences. 2016;48(1):10-15. Available from: https://pubmed.ncbi.nlm.nih.gov/26885902/
41. Shang D, Dong L, Zeng L, Yang R, Xu J, Wu Y, et al. Twostage comprehensive evaluation of genetic susceptibility of common variants in FBXO38, AP3B2 and WHAMM to severe chronic periodontitis. Scientifc Reports. 2015;5:17882. doi: 10.1038/srep17882
42. Dimou NL, Nikolopoulos GK, Hamodrakas SJ, Bagos PG. Fcgamma receptor polymorphisms and their association with periodontal disease: a meta-analysis. Journal of Clinical Periodontology. 2010;37(3):255-265. doi: 10.1111/j.1600-051X.2009.01530.x
43. Lavu V, Venkatesan V, Bhaskar LVKS, Priyanka V, Kumarasamy P, Durairaj Paul SF, et al. Polymorphic regions in fc gamma receptor and tumor necrosis factor-α genes and susceptibility to chronic periodontitis in a cohort from South India. Journal of Periodontology. 2016;87(8):914-922. doi:10.1902/jop.2016.150743.
44. Schaefer AS, Richter GM, Nothnagel M, Manke T, Dommisch H, Jacobs G, et al. A genome-wide association study identifes GLT6D1 as a susceptibility locus for periodontitis. Human Molecular Genetics. 2010;19(3):553-562. doi: 10.1093/hmg/ddp508
45. Hashim NT, Linden GJ, Ibrahim ME, Gismalla BG, Lundy FT, Hughes FJ, et al. Replication of the association of GLT6D1 with aggressive periodontitis in a Sudanese population. Journal of Clinical Periodontology. 2015;42(4):319-324. doi:10.1111/jcpe.12375
46. Kitagaki J, Miyauchi S, Asano Y, Imai A, Kawai S, Michikami I, et al. A putative association of a single nucleotide polymorphism in gpr126 with aggressive periodontitis in a japanese population. Plos one. 2016;11(8):e0160765. doi: 10.1371/journal.pone.0160765
47. Wang L, Li XH, Ning WC. Evaluation of ICAM-1 and VCAM-1 gene polymorphisms in patients with periodontal disease. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2016;22:2386-2391. doi: 10.12659/msm.896979
48. Schulz S, Pütz N, Jurianz E, Schaller HG, Reichert S. Are There any common genetic risk markers for rheumatoid arthritis and periodontal diseases? a case-control study. Mediators of Inflammation. 2019;2019:2907062. doi: 10.1155/2019/2907062
49. Shi Q, Cai C, Xu J, Liu J, Liu H, Huo N. Is there an association between IFN-α +874A/T polymorphism and periodontitis susceptibility?: A meta-analysis. Medicine. 2017;96(25):e7288. doi: 10.1097/MD.0000000000007288
50. Tanaka K, Miyake Y, Hanioka T, Arakawa M. Relationship between IL1 gene polymorphisms and periodontal disease in Japanese women. DNA and Cell Biology. 2014;33(4):227-233. doi: 10.1089/dna.2013.2202
51. Feng X, Liu J. Association between IL-1A (-889C/T) polymorphism and susceptibility of chronic periodontitis: a meta-analysis. Gene. 2020;729:144227. doi: 10.1016/j.gene.2019.144227
52. Majumder P, Panda SK, Ghosh S, Dey SK. Interleukin gene polymorphisms in chronic periodontitis: а case-control study in the Indian population. Archives of Oral Biology. 2019;101:156-164. doi: 10.1016/j.archoralbio.2019.03.015
53. Boukortt KN, Saidi-Ouahrani N, Boukerzaza B, Ouhaibi-Djellouli H, Hachmaoui K, Benaissa FZ, et al. Association analysis of the IL-1 gene cluster polymorphisms with aggressive and chronic periodontitis in the Algerian population. Archives of Oral Biology. 2015;60(10):1463-1470. doi: 10.1016/j.archoralbio.2015.06.018
54. Brodzikowska A, Górska R, Kowalski J. Interleukin-1 Genotype in Periodontitis. Archivum Immunologiae et Therapiae Experimentalis. 2019;67(6):367-373. doi: 10.1007/s00005-019-00555-4
55. Trevilatto PC, de Souza Pardo AP, Scarel-Caminaga RM, de Brito RBJ, Alvim-Pereira F, Alvim-Pereira CC, et al. Association of IL1 gene polymorphisms with chronic periodontitis in Brazilians. Archives of Oral Biology. 2011;56(1):54-62. doi: 10.1016/j.archoralbio.2010.09.004.
56. Wang WF, Shi J, Chen SJ, Niu YM, Zeng XT. Interleukin-1α -899 (+4845) C T polymorphism is not associated with aggressive periodontitis susceptibility: A meta-analysis based on 19 case-control studies. Biomedical Reports. 2014;2(3):378-383. doi: 10.3892/br.2014.240
57. Lavu V, Venkatesan V, Venkata Kameswara Subrahmanya Lakkakula B, Venugopal P, Paul SFD, Rao SR. Polymorphic regions in the interleukin-1 gene and susceptibility to chronic periodontitis: a genetic association study. Genetic Testing and Molecular Biomarkers. 2015;19(4):175-181. doi: 10.1089/gtmb.2014.0275
58. Yin WT, Pan YP, Lin L. Association between IL-1β rs17561 and IL-1α rs1143634 polymorphisms and periodontitis: a meta-analysis. Genetics and Molecular Research: GMR. 2016;15(1). doi: 10.4238/gmr.15017325
59. Hu YY, Liu JH, Jiang GB, Yuan RX, Niu YM, Shen M. Association between interleukin-1β Gene -511C>T/+3954C>T polymorphisms and aggressive periodontitis susceptibility: evidence from a meta-analysis. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2015;21:1617-1624. doi: 10.12659/MSM.894402
60. Zeng XT, Liu DY, Kwong JSW, Leng WD, Xia LY, Mao M. Meta-analysis of association between interleukin1β C-511T polymorphism and chronic periodontitis susceptibility. Journal of Periodontology. 2015;86(6):812-819. doi: 10.1902/jop.2015.140698
61. Wang HF, He FQ, Xu CJ, Li DM, Sun XJ, Chi YT, et al. Association between the interleukin-1β C-511T polymorphism and periodontitis: a meta-analysis in the Chinese population. Genetics and Molecular Research: GMR. 2017;16(1). doi: 10.4238/gmr16019315
62. Amirisetty R, Patel RP, Das S, Saraf J, Jyothy A, Munshi A. Interleukin 1β (+3954, -511 and -31) polymorphism in chronic periodontitis patients from North India. Acta Odontologica Scandinavica. 2015;73(5):343-347. doi: 10.3109/00016357.2014.961958
63. Hong SJ, Kang SW, Kim SK, Kim YS, Ban JY. Lack of association between interleukin-1β gene polymorphism (rs16944) and chronic periodontitis: from a case-control studies to an updated meta-analysis. Disease Markers. 2018;2018:8287026. doi: 10.1155/2018/8287026
64. Mazurek-Mochol M, Dembowska E, Malinowski D, Safranow K, Pawlik A. IL-1ß rs1143634 and rs16944 polymorphisms in patients with periodontal disease. Archives of Oral Biology. 2019;98:47-51. doi: 10.1016/j.archoralbio.2018.11.004
65. Chen YJ, Han Y, Mao M, Tan YQ, Leng WD, Zeng XT. Interleukin-1β rs1143634 polymorphism and aggressive periodontitis susceptibility: a meta-analysis. International Journal of Clinical and Experimental Medicine. 2015;8(2):2308-2316. Available from: https://pubmed.ncbi.nlm.nih.gov/25932167/
66. da Silva FRP, Vasconcelos ACCG, de Carvalho França LF, Di Lenardo D, Nascimento HMS, Vasconcelos DFP. Association between the rs1143634 polymorphism in interleukin-1B and chronic periodontitis: results from a meta-analysis composed by 54 case/control studies. Gene. 2018;668:97-106. doi: 10.1016/j.gene.2018.05.067
67. Isaza-Guzmán DM, Hernández-Viana M, Bonilla-León DM, Hurtado-Cadavid MC, Tobón-Arroyave SI. Determination of NLRP3 (rs4612666) and IL-1B (rs1143634) genetic polymorphisms in periodontally diseased and healthy subjects. Archives of Oral Biology. 2016;65:44-51. doi: 10.1016/j.archoralbio.2016.01.013
68. Huang W, He BY, Shao J, Jia XW, Yuan YD. Interleukin1β rs1143627 polymorphism with susceptibility to periodontal disease. Oncotarget. 2017;8(19):31406-31414. doi: 10.18632/oncotarget.15612
69. Wu X, Offenbacher S, López NJ, Chen D, Wang HY, Rogus J, et al. Association of interleukin-1 gene variations with moderate to severe chronic periodontitis in multiple ethnicities. Journal of Periodontal Research. 2015;50(1):52-61. doi: 10.1111/jre.12181
70. Mesa F, Lanza E, García L, Marfil-Alvarez R, Magan-Fernandez A. Polymorphism IL-1RN rs419598 reduces the susceptibility to generalized periodontitis in a population of European descent. PloS One. 2017;12(10):e0186366. doi: 10.1371/journal.pone.0186366
71. Vahabi S, Nazemisalman B, Hosseinpour S, Salavitabar S, Aziz A. Interleukin-2, -16, and -17 gene polymorphisms in Iranian patients with chronic periodontitis. Journal of Investigative and Clinical Dentistry. 2018;9(2):e12319. doi: 10.1111/jicd.12319
72. Jia XW, Yuan YD, Yao ZX, Wu CJ, Chen X, Chen XH, et al. Association between IL-4 and IL-4R polymorphisms and periodontitis: a meta-analysis. Disease Markers. 2017;2017:8021279. doi:10.1155/2017/8021279
Актуальность. На сегодняшний день ведутся активные исследования по поиску генетических маркеров пародонтита, обнаружение которых позволит выявлять пациентов группы риска задолго до появления первых признаков заболевания, прогнозировать течение болезни и интенсивно проводить профилактические мероприятия, направленные на устранение негативных факторов окружающей среды.
Цель – систематизация имеющихся данных по изучению ассоциации генов с развитием агрессивного и хронического генерализованного пародонтита.
Материалы и методы. С помощью поисковых систем PubMed, Google Search и eLIBRARY было найдено 214 публикаций, опубликованных с 2005 по 2020 год. Было отобрано 135 публикаций, среди которых встречались клинические исследования и данные метаанализа.
Результаты. Такие хронические воспалительные заболевания, как пародонтит, являются типично полигенными, а ассоциированные с подобными заболеваниями гены рассматриваются как гены предрасположенности. Наличие связанного с заболеванием аллеля у индивидуума не является абсолютным диагностическим признаком для развития заболевания, однако отражает риск его развития. При поиске генетических маркеров пародонтита ключевая роль отводится тем генам, которые кодируют белки, имеющие важные роли на разных этапах патогенеза воспалительных заболеваний пародонта. Среди них: дефензины, интерлейкины, Толл-подобные рецепторы, α1-цепь коллагена I типа и другие. На сегодняшний день изучено порядка 300 полиморфизмов и обнаружена ассоциация некоторых из них с развитием пародонтита.
Заключение. Точный генетический маркер пародонтита на данный момент неизвестен. Дальнейший поиск генов-кандидатов должен проходить параллельно с расширением знаний о патогенезе воспалительных заболеваний пародонта. Определение пресимптоматической предрасположенности к болезни позволит повысить качество оказания стоматологической помощи и проведения профилактических мероприятий еще до появления клинических признаков.
Ключевые слова: генетический полиморфизм, генетический предиктор, пародонтит, предрасположенность к ВЗП.
АКТУАЛЬНОСТЬ
Распространенность воспалительных заболеваний пародонта (ВЗП) в процентном отношении достигла таких масштабов, что по статистическим критериям они подходят под понятие эпидемии. Согласно эпидемиологическим данным ВОЗ, около 80% детского населения и 95% взрослого населения планеты имеют те или иные признаки заболевания тканей, окружающих и удерживающих зуб в альвеоле, при этом самым распространенным признаком заболевания является кровоточивость десен [1, 2]. Кроме роста распространенности ВЗП, отмечается устойчивая тенденция к росту тяжелых форм воспалительных заболеваний пародонта во всех возрастных группах. В России за последние годы отчетливо ощущается тенденция к снижению возраста пациентов с генерализованными формами воспалительных заболеваний пародонта [3].
Как известно, причиной развития ВЗП является наличие сложных комплексов пародонтопатогенов, которые колонизируют поверхность зуба и участвуют в формировании зубного налета [4]. Однако только присутствия бактерий недостаточно для развития пародонтита. Данное заболевание является многофакторным, в патогенезе которого большее значение имеет иммунный ответ макроорганизма на бактериальное воздействие, наличие общесоматической патологии, а также таких предрасполагающих факторов риска, как курение, плохая гигиена полости рта, стресс [2, 5, 6]. Кроме того, по крайней мере в 50% случаев восприимчивость к воспалительным заболеваниям пародонта определяется наследственностью [7]. Такие хронические воспалительные заболевания, как пародонтит, являются типично полигенными, а ассоциированные с подобными заболеваниями гены рассматриваются как гены предрасположенности. Характер течения пародонтита в каждом клиническом случае определяется индивидуальными особенностями организма человека, которые обуславливают его восприимчивость к развитию болезни. Предполагается, что по меньшей мере 20 генов могут быть связаны с предрасположенностью к пародонтиту, но какие именно гены и в каком количестве – нужно определять в каждом конкретном клиническом случае [8].
Целью данного обзора является систематизация имеющихся данных в отношении поиска генов предрасположенности к агрессивному и хроническому генерализованному пародонтиту.
ПОНЯТИЕ О SNP И МУЛЬТИФАКТОРИАЛЬНЫХ ЗАБОЛЕВАНИЯХ
Большинство заболеваний человека в своей этиологии имеет генетический компонент, однако степень его участия может сильно различаться. Изменения в генах, так называемые поломки, мутации, являющиеся одним из видов биоразнообразия, называются генетическим полиморфизмом. Подобные изменения могут быть результатом спонтанных случайных процессов или могут быть индуцированы воздействием внешних факторов (например, вирусов или излучением). Замена одного нуклеотида (SNP) является наиболее распространенной формой генетического полиморфизма в геноме человека [9]. Многие SNPs широко распространены среди индивидуумов одной популяции.
Полиэтиологические (многофакторные) хронические воспалительные заболевания, такие как пародонтит, являются результатом совокупного влияния на ткани отдельных уникальных генетических последовательностей и факторов окружающей среды (например, диета, стресс, микробные агенты), которые играют важную роль в проявлении дефектных свойств продуктов генов, вовлеченных в предрасположенность к заболеванию [9]. Итогом такого взаимодействия является появление фактического состояния болезни. Взаимосвязи между всеми факторами настолько сложны, что чрезвычайно трудно количественно определить конкретный вклад каждого компонента в развитие заболевания. Кроме того, для большинства хронических состояний требуется много лет, чтобы проявились клинические признаки [7].
В отличие от хромосомных мутаций, которые могут устранить генный продукт или изменить белковый продукт гена настолько, что это значительно повлияет на работу биологических процессов, отдельные точечные мутации обычно работают в пределах нормального диапазона функций и долгое время могут никак не проявлять себя [7]. Генетические полиморфизмы, ассоциированные с полиэтиологическими заболеваниями, такими как пародонтит, часто не напрямую с ними связаны и не являются определяющим фактором в проявлении клинических признаков в большинстве случаев. Они в значительной мере отражают лишь риск развития болезни [7, 8]. Важно понимать, что аллели, ассоциированные с заболеванием, также найдены у здоровых людей (но реже, чем у больных), а некоторые пациенты с болезнью не имеют аллеля, связанного с заболеванием. Кроме того, стоит отметить, что многофакторные заболевания появляются не из-за дефекта одного гена, в их этиологии участвуют генетические варианты сразу нескольких локусов хромосом, что ведет к их сочетанному влиянию.
Таким образом, наличие связанного с заболеванием аллеля у индивидуума не является абсолютным диагностическим признаком для развития заболевания, а знание о присутствии одной аллели у индивидуума, связанной с заболеванием, не является достаточной информацией для постановки клинического диагноза. Корреляция между генетическим полиморфизмом и клиническими проявлениями болезни, как правило, гораздо слабее, чем между хромосомными мутациями и болезнью (фенотипом) [7]. Тем не менее, измененные функции белков в различных структурных и иммунных путях показывают, что даже точечные генетические изменения различных генов при определенных условиях могут влиять на клеточные реакции, повышая тем самым восприимчивость организма к негативному воздействию окружающих факторов, что ведет к появлению патологических изменений в тканях пародонта. При этом экспрессия генов в различных тканях может варьироваться [7]. При изменении нуклеотида в последовательности ДНК продукт (белок), кодируемый геном, либо остается прежним, либо меняется его структура (за счет изменения аминокислоты) и функция, либо меняется продукция данного белка, что также отражается на течении биологических процессов. Если функции белка изменены в биологическом процессе, например при воспалительном ответе на конкретный микробный агент, определенные полиморфизмы могут увеличивать или уменьшать риск прогрессирования болезни для человека [10].
Важно иметь информацию о частоте аллелей в тестируемой популяции, а также иметь возможность количественно оценить величину эффекта ассоциированного с заболеванием аллеля на патологические процессы, то есть во сколько раз присутствие данного SNP повышает риск развития заболевания.
Измерение чувствительности и специфичности аллеля важно для расчета вероятности развития заболевания. Для этого применяют популяционный подход обнаружения ассоциированного с болезнью аллеля, основанный на стандартной схеме «случайконтроль» [7]. При этом частоты аллелей изучаемых SNP сравниваются между группой пациентов с фенотипическими проявлениями заболевания и группой контроля (клинически здоровыми людьми или отдельными лицами, случайно выбранными из населения). Частоты полиморфизмов генов-кандидатов, чьи белковые продукты играют важную роль в иммунной реакции, могут быть сопоставлены между исследуемой и контрольной группами. Значимые различия в частоте конкретных полиморфизмов между этими двумя группами свидетельствуют о том, что ген-кандидат имеет значение в определении предрасположенности к болезни [7]. Если связь аллеля с заболеванием найдена, то возможны несколько интерпретаций полученного результата [10]:
1. Ассоциированный аллель является или, наоборот, не является болезнь-предрасполагающим аллелем.
2. Ассоциированный аллель находится в неравновесном сцеплении с фактическим локусом, предрасполагающим к болезни.
3. Ассоциация обусловлена особенностями выборки, обусловленной делением по расе, этнической принадлежности, полу и т.д.
4. Ассоциация является артефактом (возможно, статистическим).
Таким образом, описанный популяционный метод может помочь выяснить патогенез заболеваний, выявить причинно-следственные связи и, в конечном итоге, выявить лиц, наиболее подверженных риску заболевания.
Изученные гены предрасположенности к пародонтиту
Гены-кандидаты и соответствующие им белки, для которых были исследованы генные полиморфизмы, как предполагаемые факторы риска для агрессивного и хронического генерализованного пародонтита, представлены в таблице.







ОБСУЖДЕНИЕ
Таким образом, на сегодняшний день существует около 307 «пародонтит связанных» генов человека [146]. Тем не менее, ни один из них не оказался существенным диагностическим или прогностическим маркером для выявления пациентов, которые подвергаются риску появления тяжелых форм пародонтита [7]. Это происходит потому, что, во-первых, как уже было сказано выше, важное значение для исследования генов, ассоциированных с болезнью, имеет тот факт, является ли заболевание моногенным или мультифакториальным. Гораздо сложнее выявить и строго продемонстрировать этиологическую роль конкретных генов в мультифакториальных нозологиях. В отличие от моногенных заболеваний, которые могут быть вызваны одной мутацией, суммарный эффект множественных генов является определяющим в восприимчивости к болезни в таких комплексных заболеваниях, как хронический пародонтит [7]. Во-вторых, при поиске генов предрасположенности может оказаться, что на риск развития пародонтита одномоментно оказывает влияние большое количество SNP, обнаружение и изучение каждого из которых займет немало времени. Стоит учитывать, что в ходе исследования также могут быть получены ложноположительные результаты, поэтому для обнаружения значимой связи генов с болезнью популяционные исследования желательно проводить на больших выборках не менее 1000 человек. В-третьих, сложности возникают из-за высокой этнической неоднородности изучаемой популяции. И, наконец, исследователи нередко сталкиваются с проблемой отсутствия четких критериев дифференциации нозологических форм ВЗП при постановке диагноза вследствие проведения нестандартизованных научных исследований.
Кроме того, большая часть генетических исследований была сосредоточена на изучении полиморфизмов генов белков, которые участвуют в клеточном и гуморальном иммунитете или метаболизме, таких как цитокины, рецепторы распознавания антигена, рецепторы клеточной поверхности, ферменты и прочее. Однако стоит учитывать, что цитокины участвуют не только в воспалительных реакциях полости рта, а имеют много других функций в организме, участвуют в системных реакциях. Так, например, цитокины ИЛ-1, ФНО-α, ИЛ-8 не только играют центральную роль в регуляции иммунных и воспалительных реакций организма на инфекции, но и опосредуют межклеточные взаимодействия при кроветворении, участвуют в межсистемных коммуникациях. ИЛ-1 и ФНО-α опосредуют общие гематологические сдвиги, характерные для ответа макроорганизма на инфекцию (лихорадка, уменьшение массы тела, синтез острофазных белков, увеличение проницаемости сосудов). ИЛ-1 обеспечивает взаимосвязь иммунной, нервной и эндокринной систем. В свою очередь ИЛ-8 стимулирует ангиогенез, а ИЛ-10 угнетает продукцию провоспалительных цитокинов. Поскольку их роль в качестве цитокинов и регуляторов воспаления является настолько многогранной, то любое изменение биологического баланса между агонистическими и антагонистическими сигналами может вызвать заболевание. Поэтому логично, что мутации в генах этих цитокинов, скорее всего, будут приводить к развитию системных заболеваний, и их проявления не ограничатся только полостью рта. В связи с этим мы предполагаем, что нужно изучать мутации в генах белков первой линии защиты эпителия полости рта. Это позволит выявить наличие дефектов в белках первой линии защиты и понять, почему прорывается этот барьер.
ЗАКЛЮЧЕНИЕ
Мы вступаем в эру персонифицированной медицины и несмотря на все имеющиеся трудности поиск генетических маркеров является актуальным. Генетические исследования могут привести к пониманию факторов, опосредующих иммунный ответ, что может объяснить, почему этот ответ часто заметно отличается у людей со схожим экологическим фоном и сопоставимыми привычками образа жизни. На фундаментальном уровне персонифицированная медицина может быть определена как принятие решения о методе лечения заболевания человека, основанное на вероятностях событий, данных взаимодействия между генетическими, клиническими особенностями и факторами окружающей среды, затрагивающими конкретного человека [146]. Применений знаний о генетическом профиле человека в стоматологии позволит повысить качество оказания медицинской помощи, проведения профилактических мероприятий, инновационной диагностики и терапии, сделает возможным идентификацию пресимптоматической предрасположенности к болезни, а также позволит создать новые биоматериалы для восстановления структур полости рта и зубов [9]. В случаях, когда существует высокая генетическая вероятность заболевания, могут быть приняты интенсивные меры профилактики до развития типичной болезни, направленные на устранение факторов окружающей среды, вызывающих болезнь [5]. Для того чтобы применить эти потенциальные новые знания о роли генов для улучшения лечения и профилактики заболеваний пародонта, мы должны не только уметь идентифицировать генетические детерминанты, но и знать, как безопасно контролировать или модулировать реакцию хозяина, вызывая желаемый иммунный ответ, или даже блокировать прогрессирование заболевания за счет отключения факторов, активирующих резорбцию кости [7].
СПИСОК ЛИТЕРАТУРЫ
1. World Health Organization. Regional office for Europe. Data and statistics. Available from: https://www.euro.who.int/en/health-topics/diseaseprevention/oral-health/data-and-statistics
2. Nazir MA. Prevalence of periodontal disease, its association with systemic diseases and prevention. International Journal of Health Sciences. 2017;11(2):72-80. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5426403/
3. Кузьмина ЭМ. Стоматологическая заболеваемость населения России / Кузьмина ЭМ, Янушевич ОО, Кузьмина ИН. – М.: Авторский тираж, 2019. – 304 с. Kuzmina EM. Dental morbidity of the population of Russia / Kuzmina EM, Yanushevich OO, Kuzmina IN. – M.: Author's edition, 2019. – 304 p.
4. Holt SC, Ebersole JL. Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the «red complex», a prototype polybacterial pathogenic consortium in periodontitis. Periodontology 2000. 2005;38(1):72-122. doi: 10.1111/j.1600-0757.2005.00113.x.
5. Bali D, Pandit N, Kathuria R, Bali A. Genetics and Aggressive Periodontal Disease: An Update Review. Journal of Oral Health and Community Dentistry. 2012;6(2):97-101. doi: 10.5005/johcd-6-2-97
6. Indriolo A, Greco S, Ravelli P, Fagiuoli S. What can we learn about biofilm/host interactions from the study of inflammatory bowel disease. Journal of Clinical Periodontology. 2011;38:36-43. doi: 10.1111/j.1600-051X.2010.01680.x.
7. Taba MJ, Souza SLS de, Mariguela VC. Periodontal disease: a genetic perspective. Brazilian Oral Research. 2012;26(1):32-38. doi: 10.1590/s1806-83242012000700006
8. Toy VE, Uslu MO. Do genetic polymorphisms affect susceptibility to periodontal disease? A literature review. Nigerian Journal of Clinical Practice. 2019;22(4):445-453. doi: 10.4103/njcp.njcp_462_18.
9. Gupta K.K., P. Tondon SK. Role of human genes on the periodontium. E-Journal of Dentistry. 2012; 2(3): 187-192. Available from: https://www.oalib.com/paper/2778198#.YT-XOk5R1PZ
10. Kinane D, Hart T. Genes and gene polymorphisms associated with periodontal disease. Critical reviews in oral biology and medicine: an official publication of the american association of oral biologists. 2003;14:430-449. doi: 10.1177/154411130301400605
11. Borilova Linhartova P, Bartova J, Poskerova H, Machal J, Vokurka J, Fassmann A, et al. Apolipoprotein E gene polymorphisms in relation to chronic periodontitis, periodontopathic bacteria, and lipid levels. Archives of Oral Biology. 2015;60(3):456-462. doi:10.1016/j.archoralbio.2014.10.003
12. Зиновьева АИ, Атрушкевич ВГ, Поляков АВ, Щагина ОА. Генетические параллели в мультифакторных моделях пародонтита с агрессивным течением и остеопороза. Российская стоматология. 2011;4(6):34-40. Режим доступа: https://www.mediasphera.ru/issues/rossijskaya-stomatologiya/2011/6/032072-6406201168 Zinovieva AI, Atrushkevich VG, Polyakov AB, Shchagina OA. Genetic parallels in multifactorial models of aggressive periodontitis and osteoporosis. Russian dentistry. 2011;4(6):34-40. Available from: https://www.mediasphera.ru/issues/rossijskaya-stomatologiya/2011/6/032072-6406201168
13. Kang SW, Kim SK, Chung JH, Ban JY. Assessment of CASP gene polymorphisms in periodontal disease. Genetics and Molecular Research: GMR. 2015;14(4):18069-18077. doi:10.4238/2015.December.22.33
14. Cavalla F, Biguetti CC, Dionisio TJ, Azevedo MCS, Martins WJ, Santos CF, et al. CCR5Δ32 (rs333) polymorphism is associated with decreased risk of chronic and aggressive periodontitis: A case-control analysis based in disease resistance and susceptibility phenotypes. Cytokine. 2018;103:142-149. doi: 10.1016/j.cyto.2017.09.022
15. Chen C, Fan X, Yu S, Liu P, Pan Y, Lin L, et al. Association between periodontitis and gene polymorphisms of HBD-1 and СD14: a meta-analysis. Archives of Oral Biology. 2019;104:141-149. doi: 10.1016/j.archoralbio.2019.05.029
16. Ishaan D, Parthasarathy H, Ponnaiyan D, Tadepalli A. The CD14 rs2569190 TT genotype is associated with chronic periodontitis. Genetic Testing and Molecular Biomarkers. 2017;21(9):560-564. doi: 10.1089/gtmb.2017.0029
17. Han M xuan, Ding C, Kyung HM. Genetic polymorphisms in pattern recognition receptors and risk of periodontitis: Evidence based on 12,793 subjects. Human Immunology. 2015;76(7):496-504. doi: 10.1016/j.humimm.2015.06.006
18. Mangalarapu M, Vinukonda S, Komaravalli P, Nagula P, Koduganti R, Korripally P, et al. Association of CDKN2BAS gene polymorphism with periodontitis and coronary artery disease from South Indian population. Gene. 2019;710. doi: 10.1016/j.gene.2019.06.002
19. Schulz S, Seitter L, Werdan K, Hofmann B, Schaller HG, Schlitt A, et al. Single nucleotide polymorphisms in long noncoding RNA, ANRIL, are not associated with severe periodontitis but with adverse cardiovascular events among patients with cardiovascular disease. Journal of Periodontal Research. 2018;53(5):714-720. doi: 10.1111/jre.12555
20. Зорина ОА, Борискина ОА. Взаимосвязь полиморфизма генов некоторых коллагенов с развитием заболеваний пародонта. The Scientific & Educational Bulletin «Health & Educational Millennium». 2012;14(5):1-3. Режим доступа: https://cyberleninka.ru/article/n/vzaimosvyaz-polimorfizma-genov-nekotoryh-kollagenov-s-razvitiemzab... Zorina OA, Boriskina OA. The relationship of gene polymorphism of some collagens with the development of periodontal diseases. The Scientific & Educational Bulletin „Health & Educational Millennium”. 2012;14(5):1-3. Available from: https://cyberleninka.ru/article/n/vzaimosvyaz-polimorfizma-genov-nekotoryh-kollagenov-s-razvitiemzab...
21. Zhang ZS. Association between COX2 -765G/C polymorphism and periodontitis in Chinese population: a meta-analysis. BMC Oral Health. 2018;18(1):32. doi: 10.1186/s12903-018-0483-9
22. Jiang L, Weng H, Chen MY, Zhang C, Zeng XT. Association between cyclooxygenase-2 gene polymorphisms and risk of periodontitis: a meta-analysis involving 5653 individuals. Molecular Biology Reports. 2014;41(7):4795-4801. doi: 10.1007/s11033-014-3350-z
23. Prakash G, Umar M, Ajay S, Bali D, Upadhyay R, Gupta KK, et al. COX-2 gene polymorphisms and risk of chronic periodontitis: a case-control study and metaanalysis. Oral Diseases. 2015;21(1):38-45. doi: 10.1111/odi.12203
24. Selvaraj SM, Christina JJ, Gurumoorthy S, Jayaraman BG, Vellaichamy A. Association of - 757T > C polymorphism of C-reactive protein gene with chronic periodontitis of South Indian population. Inflammation Research: Official Journal of the European Histamine Research Society. 2019;68(5):347-349. doi: 10.1007/s00011-019-01230-2
25. He F, Zhou Y, Wang X, Li L, Geng Y, Wang Z, et al. Functional Polymorphisms of CTLA4 associated with aggressive periodontitis in the Chinese Han Population. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology. 2018;50(3):1178-1185. doi: 10.1159/000494544
26. Grdović N, Rajić J, Petrović SM, Dinić S, Uskoković A, Mihailović M, et al. Association of CXCL12 gene promoter methylation with periodontitis in patients with diabetes mellitus type 2. Archives of Oral Biology. 2016;72:124-133. doi:10.1016/j.archoralbio.2016.08.025
27. Kavrikova D, Borilova Linhartova P, Lucanova S, Poskerova H, Fassmann A, Izakovicova Holla L. Chemokine Receptor 2 (CXCR2) Gene Variants and Their Association with Periodontal Bacteria in Patients with Chronic Periodontitis. Mediators of Infammation. 2019;2019:2061868. doi:10.1155/2019/2061868
28. Teumer A, Holtfreter B, Völker U, Petersmann A, Nauck M, Biffar R, et al. Genome-wide association study of chronic periodontitis in a general German population. Journal of Clinical Periodontology. 2013;40(11):977-985. doi: 10.1111/jcpe.12154
29. Munz M, Willenborg C, Richter GM, JockelSchneider Y, Graetz C, Staufenbiel I, et al. A genomewide association study identifies nucleotide variants at SIGLEC5 and DEFA1A3 as risk loci for periodontitis. Human Molecular Genetics. 2017;26(13):2577-2588. doi:10.1093/hmg/ddx151
30. Zupin L, Robino A, Navarra CO, Pirastu N, Di Lenarda R, Gasparini P, et al. LTF and DEFB1 polymorphisms are associated with susceptibility toward chronic periodontitis development. Oral Diseases. 2017;23(7):1001-1008. doi:10.1111/odi.12689
31. Soraia Aguiar de Melo Dias R, Carlos Mourão Pinho R, Almeida FR de, Alfredo Farias Bandeira F, Celerino da Silva R, Crovella S, et al. Evaluation of DEFB1 polymorphisms in individuals with chronic periodontitis and diabetes mellitus type 2 in a population of northeastern Brazil. Special Care in Dentistry: Official Publication of the American Association of Hospital Dentists, the Academy of Dentistry for the Handicapped, and the American Society for Geriatric Dentistry. 2018;38(4):227-233. doi: 10.1111/scd.12296
32. Саркисян НГ, Ганковская ЛВ, Тузанкина ИА, Свитич ОА, Ронь ГИ, Шершнев ВН и др. Ассоциация полиморфных маркеров в генах врожденного иммунитета у больных пародонтитом и воспалительными заболеваниями верхних дыхательных путей. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016(1):67-71. Режим доступа: https://cyberleninka.ru/article/n/assotsiatsiya-polimorfnyh-markerov-v-genah-vrozhdennogo-immuniteta... Sarkisyan NG, Gankovskaya LV, Tuzankina IA, Svitich OA, Ron GI, Shershnev VN, etc. Association of polymorphic markers in the genes of innate immunity in patients with periodontitis and infammatory diseases of the upper respiratory tract. Journal of Microbiology, Epidemiology and Immunobiology. 2016(1):67-71. Available from: https://cyberleninka.ru/article/n/assotsiatsiya-polimorfnyh-markerov-v-genah-vrozhdennogo-immuniteta...
33. Shao J, Zhang M, Wu L, Jia XW, Jin YH, Zeng XT. DEFB1 rs11362 polymorphism and risk of chronic periodontitis: a meta-analysis of unadjusted and adjusted data. Frontiers in Genetics. 2019;10:179. doi: 10.3389/fgene.2019.00179
34. Ma X, Li H, Chou H. Correlation of DEFB1 polymorphisms with chronic periodontitis in Henan Han population. Chinese journal of medical genetics. 2019;36(4):371-375. doi:10.3760/cma.j.issn.1003-9406.2019.04.020
35. Ikuta T, Inagaki Y, Tanaka K, Saito T, Nakajima Y, Bando M, et al. Gene polymorphism of β-defensin-1 is associated with susceptibility to periodontitis in Japanese. Odontology. 2015;103(1):66-74. doi: 10.1007/s10266-013-0139-9
36. Kurt-Bayrakdar S, Ozturk A, Kara N. DEFB4A promoter polymorphism is associated with chronic periodontitis: a case-control study. Genetic Testing and Molecular Biomarkers. 2020;24(3):113-119. doi: 10.1089/gtmb.2019.0218
37. Bevilacqua L, Navarra CO, Pirastu N, Lenarda R Di, Gasparini P, Robino A. A genome-wide association study identifes an association between variants in EFCAB4B gene and periodontal disease in an Italian isolated population. Journal of Periodontal Research. 2018;53(6):992-998. doi:10.1111/jre.12598
38. Silveira VRS, Pigossi SC, Scarel-Caminaga RM, Cirelli JA, Rêgo R, Nogueira NAP. Analysis of polymorphisms in Interleukin 10, NOS2A, and ESR2 genes in chronic and aggressive periodontitis. Brazilian Oral Research. 2016; 30(1):e105. doi: 10.1590/1807-3107BOR-2016.vol30.0105
39. Weng H, Zhang C, Hu YY, Yuan RX, Zuo HX, Yan JZ, et al. Association between estrogen receptor-α gene XbaI and PvuII polymorphisms and periodontitis susceptibility: a meta-analysis. Disease Markers. 2015;2015:741972. doi: 10.1155/2015/741972
40. Song W li, Tian Y, Wang X e, Zhang L, Xu L, Shi D, et al. Association between FADS1 rs174537 polymorphism and serum proteins in patients with aggressive periodontitis. Journal of Peking University Health sciences. 2016;48(1):10-15. Available from: https://pubmed.ncbi.nlm.nih.gov/26885902/
41. Shang D, Dong L, Zeng L, Yang R, Xu J, Wu Y, et al. Twostage comprehensive evaluation of genetic susceptibility of common variants in FBXO38, AP3B2 and WHAMM to severe chronic periodontitis. Scientifc Reports. 2015;5:17882. doi: 10.1038/srep17882
42. Dimou NL, Nikolopoulos GK, Hamodrakas SJ, Bagos PG. Fcgamma receptor polymorphisms and their association with periodontal disease: a meta-analysis. Journal of Clinical Periodontology. 2010;37(3):255-265. doi: 10.1111/j.1600-051X.2009.01530.x
43. Lavu V, Venkatesan V, Bhaskar LVKS, Priyanka V, Kumarasamy P, Durairaj Paul SF, et al. Polymorphic regions in fc gamma receptor and tumor necrosis factor-α genes and susceptibility to chronic periodontitis in a cohort from South India. Journal of Periodontology. 2016;87(8):914-922. doi:10.1902/jop.2016.150743.
44. Schaefer AS, Richter GM, Nothnagel M, Manke T, Dommisch H, Jacobs G, et al. A genome-wide association study identifes GLT6D1 as a susceptibility locus for periodontitis. Human Molecular Genetics. 2010;19(3):553-562. doi: 10.1093/hmg/ddp508
45. Hashim NT, Linden GJ, Ibrahim ME, Gismalla BG, Lundy FT, Hughes FJ, et al. Replication of the association of GLT6D1 with aggressive periodontitis in a Sudanese population. Journal of Clinical Periodontology. 2015;42(4):319-324. doi:10.1111/jcpe.12375
46. Kitagaki J, Miyauchi S, Asano Y, Imai A, Kawai S, Michikami I, et al. A putative association of a single nucleotide polymorphism in gpr126 with aggressive periodontitis in a japanese population. Plos one. 2016;11(8):e0160765. doi: 10.1371/journal.pone.0160765
47. Wang L, Li XH, Ning WC. Evaluation of ICAM-1 and VCAM-1 gene polymorphisms in patients with periodontal disease. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2016;22:2386-2391. doi: 10.12659/msm.896979
48. Schulz S, Pütz N, Jurianz E, Schaller HG, Reichert S. Are There any common genetic risk markers for rheumatoid arthritis and periodontal diseases? a case-control study. Mediators of Inflammation. 2019;2019:2907062. doi: 10.1155/2019/2907062
49. Shi Q, Cai C, Xu J, Liu J, Liu H, Huo N. Is there an association between IFN-α +874A/T polymorphism and periodontitis susceptibility?: A meta-analysis. Medicine. 2017;96(25):e7288. doi: 10.1097/MD.0000000000007288
50. Tanaka K, Miyake Y, Hanioka T, Arakawa M. Relationship between IL1 gene polymorphisms and periodontal disease in Japanese women. DNA and Cell Biology. 2014;33(4):227-233. doi: 10.1089/dna.2013.2202
51. Feng X, Liu J. Association between IL-1A (-889C/T) polymorphism and susceptibility of chronic periodontitis: a meta-analysis. Gene. 2020;729:144227. doi: 10.1016/j.gene.2019.144227
52. Majumder P, Panda SK, Ghosh S, Dey SK. Interleukin gene polymorphisms in chronic periodontitis: а case-control study in the Indian population. Archives of Oral Biology. 2019;101:156-164. doi: 10.1016/j.archoralbio.2019.03.015
53. Boukortt KN, Saidi-Ouahrani N, Boukerzaza B, Ouhaibi-Djellouli H, Hachmaoui K, Benaissa FZ, et al. Association analysis of the IL-1 gene cluster polymorphisms with aggressive and chronic periodontitis in the Algerian population. Archives of Oral Biology. 2015;60(10):1463-1470. doi: 10.1016/j.archoralbio.2015.06.018
54. Brodzikowska A, Górska R, Kowalski J. Interleukin-1 Genotype in Periodontitis. Archivum Immunologiae et Therapiae Experimentalis. 2019;67(6):367-373. doi: 10.1007/s00005-019-00555-4
55. Trevilatto PC, de Souza Pardo AP, Scarel-Caminaga RM, de Brito RBJ, Alvim-Pereira F, Alvim-Pereira CC, et al. Association of IL1 gene polymorphisms with chronic periodontitis in Brazilians. Archives of Oral Biology. 2011;56(1):54-62. doi: 10.1016/j.archoralbio.2010.09.004.
56. Wang WF, Shi J, Chen SJ, Niu YM, Zeng XT. Interleukin-1α -899 (+4845) C T polymorphism is not associated with aggressive periodontitis susceptibility: A meta-analysis based on 19 case-control studies. Biomedical Reports. 2014;2(3):378-383. doi: 10.3892/br.2014.240
57. Lavu V, Venkatesan V, Venkata Kameswara Subrahmanya Lakkakula B, Venugopal P, Paul SFD, Rao SR. Polymorphic regions in the interleukin-1 gene and susceptibility to chronic periodontitis: a genetic association study. Genetic Testing and Molecular Biomarkers. 2015;19(4):175-181. doi: 10.1089/gtmb.2014.0275
58. Yin WT, Pan YP, Lin L. Association between IL-1β rs17561 and IL-1α rs1143634 polymorphisms and periodontitis: a meta-analysis. Genetics and Molecular Research: GMR. 2016;15(1). doi: 10.4238/gmr.15017325
59. Hu YY, Liu JH, Jiang GB, Yuan RX, Niu YM, Shen M. Association between interleukin-1β Gene -511C>T/+3954C>T polymorphisms and aggressive periodontitis susceptibility: evidence from a meta-analysis. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research. 2015;21:1617-1624. doi: 10.12659/MSM.894402
60. Zeng XT, Liu DY, Kwong JSW, Leng WD, Xia LY, Mao M. Meta-analysis of association between interleukin1β C-511T polymorphism and chronic periodontitis susceptibility. Journal of Periodontology. 2015;86(6):812-819. doi: 10.1902/jop.2015.140698
61. Wang HF, He FQ, Xu CJ, Li DM, Sun XJ, Chi YT, et al. Association between the interleukin-1β C-511T polymorphism and periodontitis: a meta-analysis in the Chinese population. Genetics and Molecular Research: GMR. 2017;16(1). doi: 10.4238/gmr16019315
62. Amirisetty R, Patel RP, Das S, Saraf J, Jyothy A, Munshi A. Interleukin 1β (+3954, -511 and -31) polymorphism in chronic periodontitis patients from North India. Acta Odontologica Scandinavica. 2015;73(5):343-347. doi: 10.3109/00016357.2014.961958
63. Hong SJ, Kang SW, Kim SK, Kim YS, Ban JY. Lack of association between interleukin-1β gene polymorphism (rs16944) and chronic periodontitis: from a case-control studies to an updated meta-analysis. Disease Markers. 2018;2018:8287026. doi: 10.1155/2018/8287026
64. Mazurek-Mochol M, Dembowska E, Malinowski D, Safranow K, Pawlik A. IL-1ß rs1143634 and rs16944 polymorphisms in patients with periodontal disease. Archives of Oral Biology. 2019;98:47-51. doi: 10.1016/j.archoralbio.2018.11.004
65. Chen YJ, Han Y, Mao M, Tan YQ, Leng WD, Zeng XT. Interleukin-1β rs1143634 polymorphism and aggressive periodontitis susceptibility: a meta-analysis. International Journal of Clinical and Experimental Medicine. 2015;8(2):2308-2316. Available from: https://pubmed.ncbi.nlm.nih.gov/25932167/
66. da Silva FRP, Vasconcelos ACCG, de Carvalho França LF, Di Lenardo D, Nascimento HMS, Vasconcelos DFP. Association between the rs1143634 polymorphism in interleukin-1B and chronic periodontitis: results from a meta-analysis composed by 54 case/control studies. Gene. 2018;668:97-106. doi: 10.1016/j.gene.2018.05.067
67. Isaza-Guzmán DM, Hernández-Viana M, Bonilla-León DM, Hurtado-Cadavid MC, Tobón-Arroyave SI. Determination of NLRP3 (rs4612666) and IL-1B (rs1143634) genetic polymorphisms in periodontally diseased and healthy subjects. Archives of Oral Biology. 2016;65:44-51. doi: 10.1016/j.archoralbio.2016.01.013
68. Huang W, He BY, Shao J, Jia XW, Yuan YD. Interleukin1β rs1143627 polymorphism with susceptibility to periodontal disease. Oncotarget. 2017;8(19):31406-31414. doi: 10.18632/oncotarget.15612
69. Wu X, Offenbacher S, López NJ, Chen D, Wang HY, Rogus J, et al. Association of interleukin-1 gene variations with moderate to severe chronic periodontitis in multiple ethnicities. Journal of Periodontal Research. 2015;50(1):52-61. doi: 10.1111/jre.12181
70. Mesa F, Lanza E, García L, Marfil-Alvarez R, Magan-Fernandez A. Polymorphism IL-1RN rs419598 reduces the susceptibility to generalized periodontitis in a population of European descent. PloS One. 2017;12(10):e0186366. doi: 10.1371/journal.pone.0186366
71. Vahabi S, Nazemisalman B, Hosseinpour S, Salavitabar S, Aziz A. Interleukin-2, -16, and -17 gene polymorphisms in Iranian patients with chronic periodontitis. Journal of Investigative and Clinical Dentistry. 2018;9(2):e12319. doi: 10.1111/jicd.12319
72. Jia XW, Yuan YD, Yao ZX, Wu CJ, Chen X, Chen XH, et al. Association between IL-4 and IL-4R polymorphisms and periodontitis: a meta-analysis. Disease Markers. 2017;2017:8021279. doi:10.1155/2017/8021279
Характеристики
|
Автор книги
|
Е.А. Тихомирова |
|
Год выпуска
|
2022 |
Задать вопрос
Задать вопрос
Новости
Все новости
25 марта 2025
Образовательное кредитование: пособие для студентов СПО
20 октября 2023
Кредит на образование с господдержкой




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
