ИНДЕКС ГИГИЕНЫ ПОЛОСТИ РТА И НЕКОТОРЫЕ ПОКАЗАТЕЛИ РОТОВОЙ ЖИДКОСТИ У ПАЦИЕНТОВ С ПОСТКОВИДНЫМ СИНДРОМОМ ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ ЗУБНЫХ ПАСТ
Нет в наличии
Описание
Резюме
Актуальность. За последние два года в научной литературе опубликовано значительное количество данных о проявлении новой коронавирусной инфекции в полости рта во время заболевания. Однако имеются лишь единичные исследования по стоматологическому статусу у пациентов с постковидным синдромом. Цель исследования – определить индекс гигиены и некоторые показатели ротовой жидкости у пациентов с постковидным синдромом при использовании различных зубных паст.
Материалы и методы. Обследованы 68 пациентов в возрасте 27-40 лет, переболевших коронавирусной инфекцией не более чем за шесть месяцев до момента начала исследования. Группу контроля составили пациенты, не болевшие коронавирусной инфекцией. На первом этапе сравнивали некоторые показатели свойств и состава ротовой жидкости у пациентов, не болевших новой коронавирусной инфекцией с такими же показателями у пациентов, переболевших коронавирусной инфекцией и имеющих постковидный синдром. На втором этапе пациенты распределены по группам в зависимости от используемой зубной пасты. У всех пациентов определяли индекс гигиены полости рта и некоторые показатели ротовой жидкости.
Результаты. У пациентов с постковидным синдромом снижена скорость саливации, увеличена вязкость слюны, снижен минерализующий потенциал слюны, снижена активность лизоцима и уменьшена концентрация кателицидина LL-37 в ротовой жидкости. Установлено, что пациенты, использующие для ухода за полостью рта увлажняющую зубную пасту (R.O.C.S. Moisturizing), имели более высокие показатели скорости саливации, активности лизоцима, кателицидина LL-37, чем пациенты, использующие зубные пасты с хлоргексидином и лаурилсульфатом натрия. Также уровень гигиены полости рта у первой группы пациентов был достоверно выше.
Заключение. Установлено, что у пациентов с постковидным синдромом значительно изменены некоторые показатели ротовой жидкости. Достоверно выявлено, что на показатели оказывает влияние выбор зубной пасты. Для данной группы пациентов важно использовать зубную пасту, улучшающую свойства ротовой жидкости. Использование зубной пасты R.O.C.S. Moisturizing обеспечивает улучшение свойство ротовой жидкости у пациентов с постковидным синдромом.
Ключевые слова: постковидный синдром, ротовая жидкость, зубная паста, кателицидин LL-37.
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Появление COVID-19 в мире поставило перед специалистами разного профиля здравоохранения задачи, связанные не только с быстрой диагностикой и лечением, но и с оказанием качественной медицинской помощи, включающей реабилитационные мероприятия после и во время коронавирусной инфекции [1-19]. National Institute for Health and Care Excellence (NICE) в соглашении с Scottish Intercollegiate Guidelines Network и The Royal College of General Practitioners в своих рекомендациях 30 октября 2020 года впервые описали следующие формы COVID-19:
1) острый COVID-19 (acute COVID-19) – жалобы и симптомы COVID-19 продолжительностью до 4 недель;
2) продолжающийся симптоматический COVID-19 (ongoing symptomatic COVID-19) – жалобы и симптомы COVID-19 продолжительностью от 4 до 12 недель;
3) постковидный синдром (post-COVID-19 syndrome) — жалобы и симптомы, которые развиваются во время или после COVID-19 и длятся больше 12 недель и не являются результатом другого диагноза.
В МКБ-10 появился отдельный̆ код для описания постковидного синдрома (ПКС). Код U09.9 – Состояние после COVID-19. Этот код позволяет установить связь с COVID-19. Постковидный синдром, скорее всего, не является уникальным явлением и совпадает по своим клиническим проявлениям с миалгичесим энцефаломиелитом (синдром хронической усталости) [19-20], постинфекционными состояниями. Скорее всего, и другие известные постинфекционные осложнения могут иметь общую природу, которые проявляется частыми головными болями, астеническим синдромом с эмоциональной лабильностью, гневливостью, злобностью, агрессивностью, головокружениями и шаткостью походки, забывчивостью, замедленностью темпа мышления, снижением внимания, расстройствами памяти, невозможностью выполнять повседневные обязанности, возникновением зависимости от близких, оскуднением словесного запаса, потерей интереса к традиционным увлечениям, сужением круга общения [20].
За последние два года в научной литературе опубликовано значительное количество данных о проявлении новой коронавирусной инфекции в полости рта во время заболевания. Однако имеются лишь единичные исследования по стоматологическому статусу у пациентов с постковидным синдромом.
Смешанная слюна (ротовая жидкость) является естественной реминерализирующей жидкостью и играет важнейшую роль в формировании резистентности зубов к кариозному поражению за счет поддержания физиологического равновесия процессов ре- и деминерализации в эмали. Состав и свойства ротовой жидкости, безусловно, влияют на стоматологический статус пациента [19-24].
Кателицидин LL-37 – вещество, которое синтезируется в кератиноцитах, нейтрофилах в виде неактивного предшественника, состоящего из N-концевого кателинподобного и С-концевого антимикробного доменов. Кателицидин LL-37 обладает противовирусными, противогрибковыми и антибактериальными свойствами за счет электростатического взаимодействия с мембранами клеток. Концентрация пептида LL-37 растет при повреждениях кожи или слизистых оболочек в различных стрессовых ситуациях, что позволяет отнести его к сигналам тревоги [25].
Многими исследователями установлено влияние зубных паст на состав и свойства ротовой жидкости. Установлено, что зубные пасты с растительными экстрактами, не содержащие лаурилсульфат натрия, благотворно влияют на состояние полости рта [26-30].
Цель исследования – определить индекс гигиены и некоторые показатели ротовой жидкости у пациентов с ПКС при использовании различных зубных паст.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами обследованы 68 пациентов в возрасте 27-40 лет, переболевших коронавирусной инфекцией не более чем за шесть месяцев до момента начала исследования. Группу контроля составили пациенты, не болевшие коронавирусной инфекцией (16 человек). Полость рта у всех пациентов была санирована, интенсивность кариеса находилась в пределах от 7 до 13. На момент осмотра в полости рта у пациентов не было воспалительных заболеваний. У всех пациентов показатели индекса гигиены были сопоставимы. Пищевые привычки были приблизительно одинаковыми. Со слов пациентов, соматические патологии отсутствуют, вредные привычки отрицают.
На первом этапе сравнивали некоторые показатели свойств и состава ротовой жидкости у пациентов, не болевших новой коронавирусной инфекцией с такими же показателями у пациентов, переболевших коронавирусной инфекцией и имеющих ПКС.
Распределение в группы на втором этапе исследования происходило на основании анкетных данных и завесило от используемой зубной пасты на протяжении шести месяцев после заболевания.
В первую группу вошли 24 пациента с постковидным синдромом, использовавшие увлажняющую зубную пасту R.O.C.S. Moisturizing (зубная паста не содержит хлоргексидина и лаурилсульфата).
Вторую группу составил 21 пациент, использовавший зубную пасту с хлоргексидином (зубные пасты не содержали лаурилсульфата натрия). 23 пациента третьей группы использовали зубную пасту с лаурилсульфатом (sodium lauryl sulfate).
В течение периода заболевания все пациенты, переболевшие коронавирусной инфекцией, использовали одинаковую схему лечения, включая антикоагулянты, антибиотики, витамины. У всех пациентов был зарегистрирован врачом-терапевтом ПКС (МКБ-10 U09.9 Состояние после COVID-19 неуточненное), который характеризовался следующими симптомами, подтвержденными анкетными данными: нарушение общего самочувствия, приступы слабости, снижение толерантности к физическим нагрузкам, боли в мышцах, суставах, головные боли, парестезии, нарушение ритмов жизнедеятельности, одышка.
Всем пациентам был проведен осмотр один раз через шесть месяцев от начала заболевания коронавирусной инфекцией и дополнительные осмотры в течение срока наблюдения. Скорость саливации слюны (СС) определяли по методике Рединовой Т. Л., Поздеева А. Р. (1994) путем сбора в стерильные мерные пробирки. Слюну собирали обычно в течение 5-15 минут. Пациенту предлагалось наклонить подбородок вниз к груди.
Скорость саливации определялась по следующей формуле:
СС = V / t (мл/мин),
где V – объем выделенной слюны в мл; t – время сбора слюны в минутах.
Вязкость смешанной слюны определяли по упрощенной методике Рединовой – Поздеева (1994) в относительных единицах. Норма вязкости смешанной слюны: 1,2-2,4 сП.
Активность лизоцима (АЛ) в ротовой жидкости определяли фотонефелометрическим методом Дорофейчук В. Г. (1968) на спектрофотометре «PV 1251 С». Из тест-культуры m. Lysodeikticus готовили взвесь в фосфатном буфере рН = 7,2-7,4. Далее фильтровали и стандартизировали по ФЭК56 при использовании зеленого светофильтра (длина рабочей волны Л = 540 нм) в кювете с рабочей длиной 3 мм. При нефелометрии светопропускание исходной взвеси доводили до 20% (4 млрд бактерий). К 1,47 мл приготовленной микробной взвеси добавляли 0,03 мл исследуемого субстрата. Пробирки выдерживали при температуре +37 °С в течение 60 минут и проводили нефелометрию при тех же условиях, которые соблюдали при стандартизации исходной взвеси. Для определения процента активности лизоцима из процента светопропускания испытуемой взвеси вычитали процент светопропускания исходной микробной взвеси (20%). Исследуемая слюна разводилась фосфатным буфером в соотношении 1:20.
Определение рН ротовой жидкости проводилось при помощи индикаторных полосок бумаги (ФАН) с интервалом рН 5,4-7,8, шагом 0,2.
Для определения минерализующего потенциала слюны использовали индекс МПС (3) по Леусу (1977 г.) На предметное стекло, предварительно обработанное спиртом и эфиром, наносили не менее трех капель ротовой жидкости. Микропрепараты высушивали при комнатной температуре. Высохшие капли изучали под микроскопом в отраженном свете при небольшом увеличении. Характер рисунка на стекле оценивали по 5-балльной шкале в зависимости от выявленных типов кристаллообразования: 0 баллов – полное отсутствие кристаллов в поле зрения; 1 балл – по всей площади капли обнаруживается большое количество равномерно расположенных структур неправильной формы; 2 балла – кристаллы различной формы располагаются равномерно в виде сеточки по всему полю или сгруппированы по периферии капли, а в поле зрения находится много органического вещества; 3 балла – в центре капли располагаются отдельные дендритные кристаллопризматические структуры, а по периферии находится большое число призматических структур неправильной формы; 4 балла – в центре капли обнаруживается четкий рисунок крупных удлиненных кристаллопризматических структур, сросшихся между собой и имеющих древовидную или папоротникообразную форму, в то время как органическое вещество располагается в небольшом количестве по периферии, 5 баллов – по всей капле определяется четкий рисунок крупных удлиненных кристаллопризматических структур.
Содержание кателицидина LL-37 в ротовой жидкости определяли методом иммуноферментного анализа [31].
Индекс гигиены определяли по O’Leary путем окрашивания всех зубов и расчета процентного отношения окрашенных поверхностей (O’Leary T., Drake R., Naylor, 1972). Обработку результатов проводили c использованием программы Statistica 10,0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате исследования установлено, что скорость саливации у пациентов с постковидным синдромом составляет 0,41 ± 0,03 мл/мин, у пациентов, не болевших новой коронавирусной инфекцией, показатель составил 0,54 ± 0,02 мл/мин (табл. 1).
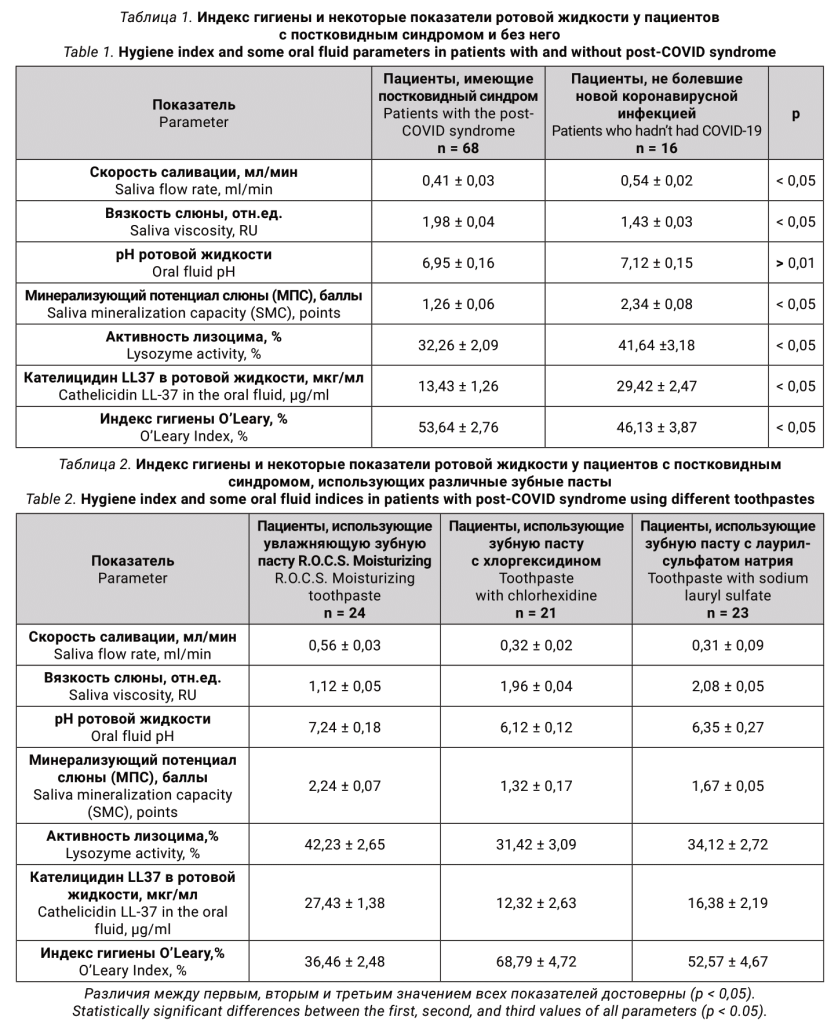
Значение показателя вязкости слюны у пациентов, имеющих постковидный синдром, было 1,98 ± 0,04 отн. ед. Данный показатель у пациентов, не болевших новой коронавирусной инфекцией, составил 1,43 ± 0,03 отн. ед. (табл. 1).
Значение показателя pH ротовой жидкости у пациентов с постковидным синдромом составило 6,95 ± 0,16, тогда как у не болевших пациентов показатель был 7,12 ± 0,15 (табл. 1).
Показатель минерализующего потенциала слюны (МПС) у пациентов, имеющих посковидный синдром, составил 1,2 6± 0,06 баллов. Значение МПС у пациентов, не болевших коронавирусной инфекцией, было 2,34 ± 0,08 баллов.
В результате исследования показатели активности лизоцима в ротовой жидкости у пациентов с постковидным синдромом составили 32,26 ± 2,09%, у пациентов, не болевших новой коронавирусной инфекцией, значение было 41,64 ± 3,18% (табл. 1).
Концентрация кателицидина в ротовой жидкости у пациентов с постковидным синдромом составила 13,43 ± 1,26 мкг/мл, у не болевших пациентов – 29,42 ± 2,47 мкг/мл. Индекс гигиены у пациентов с постковидным синдромом был значительно хуже по сравнению с показателем у пациентов, не имеющих данного синдрома (табл. 1).
В результате исследования установлено, что скорость саливации у пациентов с постковидным синдромом, использовавших зубную пасту R.O.C.S. Moisturizing, составила 0,56 ± 0,03 мл/мин, у пациентов, использовавших зубную пасту с хлоргексидином, данный показатель был 0,32 ± 0,02 мл/мин. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели скорость саливации 0,31 ± 0,09 мл/мин (табл. 2).
Значение показателя вязкости слюны у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing было 1,12 ± 0,05 отн. ед. Данный показатель у пациентов, использовавших зубную пасту с хлоргексидином, составил 1,96 ± 0,04 отн. ед. В результате исследования выявлено, что вязкость слюны у пациентов, использовавших пасту с лаурилсульфатом натрия, была 2,08 ± 0,05 отн. ед.
В результате исследования, значение показателя pH ротовой жидкости у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing составило 7,24 ± 0,18, тогда как у пациентов, использовавших зубную пасту с хлоргексидином данный показатель был 6,12 ± 0,12. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели pH ротовой жидкости 6,35 ± 0,27.
Показатель минерализующего потенциала слюны (МПС) у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing, составил 2,24 ± 0,07 баллов. Значение МПС у пациентов, использовавших зубную пасту с хлоргексидином, было 1,32 ± 0,17 баллов. В результате исследования выявлено, что показатель МПС у пациентов, использовавших пасту с лаурилсульфатом натрия, в среднем был 1,67 ± 0,05 балла.
Показатели активности лизоцима в ротовой жидкости у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing, составили 42,23 ± 2,65%, у пациентов, использовавших зубную пасту с хлоргексидином, данные значения были в пределах 31,42 ± 3,09%. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели показатель активности лизоцима 34,12 ± 2,72%.
Концентрация кателицидина в ротовой жидкости у пациентов, использовавших зубную пасту, составила R.O.C.S. Moisturizing 27,43 ± 1,38 мкг/мл, у пациентов, использовавших зубную пасту с хлоргексидином, – 12,32 ± 2,63 мкг/мл. В результате исследования выявлено, что концентрация кателецедина в ротовой жидкости у пациентов, использовавших пасту с лаурилсульфатом натрия, составила 16,38 ± 2,19 мкг/мл.
Индекс гигиены у пациентов, использующих зубную пасту R.O.C.S. Moisturizing в течение трех месяцев, был значительно лучше, чем у пациентов, использующих пасты с хлоргексидином и лаурилсульфатом натрия (табл. 2).
ЗАКЛЮЧЕНИЕ
Установлено, что у пациентов с постковидным синдромом значительно изменены некоторые показатели ротовой жидкости. Достоверно выявлено, что на показатели оказывает влияние выбор зубной пасты. Использование зубной пасты R.O.C.S. Moisturizing обеспечивает улучшение свойств ротовой жидкости у пациентов с постковидным синдромом.
СПИСОК ЛИТЕРАТУРЫ
1. Amorim Dos Santos J, NormandoAGC, Carvalho da Silva RL, Acevedo AC, De Luca Canto G, Sugaya N, et al. Oral Manifestations in Patients with COVID-19: A Living Systematic Review. Journal of Dental research. 2021 Feb;100(2):141-154. doi:10.1177/0022034520957289
2. Ather A, Patel B, Ruparel NB. Coronavirus disease 19 (COVID-19): implications for clinical dental care. Journal of endodontics. 2020;46:584-595. doi:10.1016/j.joen.2020.03.008
3. Bidra AS, Pelletier JS, Westover JB, Frank S, Brown SM, Tessema B.J Comparison of In Vitro Inactivation of SARS CoV-2 with Hydrogen Peroxide and Povidone-Iodine Oral Antiseptic Rinses. Journal of Prosthodontics. 2020 Aug;29(7):599-603. doi:10.1111/jopr.13220
4. Burton MJ, Clarkson JE, Goulao B, Glenny AM, McBain AJ, Schilder AG, Webster KE, et al. Antimicrobial mouthwashes (gargling) and nasal sprays administered to patients with suspected or confirmed COVID-19 infection to improve patient outcomes and to protect healthcare workers treating them. cochrane Database of Systematic reviews. 2020 Sep 16;9(9):CD013627. doi: 10.1002/14651858.CD013627.pub2
5. Peng X, Xu X, Li Y. Transmission routes of 2019-nCoV and controls in dental practice. international Journal of oral Science. 2020;12:9. doi:10.1038/s41368-020-0075-9
6. Cox-Georgian D, Ramadoss N, Dona C. Therapeutic and medicinal uses of terpenes. In: Joshee N, Dhekney SA, Parajuli P, editors. Medicinal plants: from farm to pharmacy. 2019:333-359. doi: 10.1007/978-3-030-31269-5_15
7. Dominiak M, Shuleva S, Silvestros S. A prospective observational study on perioperative use of antibacterial agents in implant surgery. advances in clinical and experimental Medicine. 2020;29:355-363. doi:10.17219/acem/115087
8. Levy E, Delvin E, Marcil V. Can phytotherapy with polyphenols serve as a powerful approach for the prevention and therapy tool of novel coronavirus disease 2019 (COVID-19)? aJP endocrinology and Metabolism. 2020;319(4):E689-E708. doi:10.1152/ajpendo.00298.2020
9. Marui VC, Souto MLS, Rovai ES. Efficacy of preprocedural mouthrinses in the reduction of microorganisms in aerosol: a systematic review. Journal of the american Dental association. 2019;150:1015-1026.e1. doi:10.1016/j.adaj.2019.06.024
10. Mateos-Moreno MV, Mira A, Ausina-Márquez V, Ferrer MD Oral antiseptics against coronavirus: in-vitro and clinical evidence. the Journal of hospital infection. 2021 Jul;113:30-43. doi:10.1016/j.jhin.2021.04.004
11. Math MV, Kattimani YR, Gadda RB, Khadkikar RM. Plant products in reducing spread of coronavirus infection (COVID-19). british Journal of oral and Maxillofacial Surgery. 2021 May;59(4):497-498. doi: 10.1016/j.bjoms.2020.11.005
12. Seneviratne CJ, Balan P, Ko KKK, Udawatte NS, Lai D, Ng DHL, Venkatachalam I, et al. Efcacy of commercial mouth-rinses on SARS-CoV-2 viral load in saliva: randomized control trial in Singapore. infection. 2021 Apr;49(2):305-311. doi:10.1007/s15010-020-01563-9
13. Vergara-Buenaventura A, Castro-Ruiz C. Use of mouthwashes against COVID-19 in dentistry. british Journal of oral and Maxillofacial Surgery. 2020 Oct;58(8):924-927. doi: 10.1016/j.bjoms.2020.08.016
14. Рекомендации по ведению больных с коронавирусной инфекцией COVID-19 в острой фазе и при постковидном синдроме в амбулаторных условиях. Под ред. проф. Воробьева П.А. Проблемы стандартизации в здравоохранении. 2021;7-8:3-96. Режим доступа: https://doi.org/10.26347/1607-2502202107-08003-096
15. Сатыго ЕА, Бакулин ИГ. Клинические и микробиологические признаки кандидоза полости рта у пациентов с COVID-19, получающих различную патогенетическую терапию и имеющих разный уровень гигиены полости рта. Пародонтология. 2021;26(1):4-8. doi: https://doi.org/10.33925/1683-3759-2021-26-1-4-8
16. Силин АВ, Зуева ЛП, Сатыго ЕА, Молчановская МА. Эпидемиологические особенности и инфекционный контроль при COVID-19 в стоматологической практике (научный обзор). Профилактическая и клиническая медицина. 2020;2(75):5-10. Режим доступа: https://profclinmed.szgmu.ru/PIK_2-2020.pdf
17. Barker-Davies RM, O’Sullivan O, Senaratne KPP, Baker P, Cranley M, Dharm-Datta S, Ellis H, et al. The Stanford Hall consensus statement for post-COVID-19 rehabilitation. british Journal of Sports Medicine. 2020 Aug;54(16):949-959. doi: 10.1136/bjsports-2020-102596
18. Kamal M, Abo Omirah M, Hussein A, Saeed H. Assessment and characterisation of post-COVID-19 manifestations. international Journal of clinical Practice. 2021 Mar;75(3):e13746. doi:10.1111/ijcp.13746
19. Pedersen AML, Sørensen CE, Proctor GB, Carpenter GH, EkströmJ. Salivary secretion in health and disease. Journal of oral rehabilitation. 2018 Sep;45(9):730-746. doi:10.1111/joor.12664
20. Carpenter GH. The secretion, components, and properties of saliva. annual review of Food Science and technology. 2013;4:267-76. doi: 10.1146/annurev-food-030212-182700
21. Mikhaylenko TN, Ernestyuk AM, Rozhko NM. The dynamics of changes in rheological properties of oral fluid in patients with different levels of oral hygiene, using removable dentures. Georgian Medical news. 2014 Dec;(237):19-24.
22. Roblegg E, Coughran A, SirjaniD. Saliva: An all-rounder of our body. european Journal of Pharmaceutics and biopharmaceutics. 2019 Sep;142:133-141. doi: 10.1016/j.ejpb.2019.06.016
23. Gray-Stuart EM, Jones JR, BronlundJE. Defining the end-point of mastication: A conceptual model. Journal of texture Studies. 2017 Oct;48(5):345-356. doi: 10.1111/jtxs.12253
24. Zhao Y, Yin LY, Bi RR, Ma P, Li SB. Current advance in saliva-derived exosome study. Zhonghua Kou Qiang Yi Xue Za Zhi. chinese journal of stomatology. 2016;Dec;9;51(12):765-769. doi: 10.3760/cma.j.issn.1002-0098.2016.12.012
25. Тырнова ЕВ, Алешина ГМ, Янов ЮК, Кокряков ВН. Оценка экспрессии генов кателицидина ll-37 и бетадефенсинов-1, -2, -3 человека в слизистой оболочке среднего уха при хронических воспалительных заболеваниях. Современные проблемы науки и образования. 2017;5:106. Режим доступа: https://elibrary.ru/item.asp?id=30457909
26. Janakiram C, Venkitachalam R, Fontelo P, Iafolla TJ, Dye BA. Effectiveness of herbal oral care products in reducing dental plaque & gingivitis – a systematic review and meta-analysis. bMc complementary Medicine and therapies. 2020 Feb 11;20(1):43. doi: 10.1186/s12906-020-2812-1
27. Juntarachot N, Sirilun S, Kantachote D, Sittiprapaporn P, Tongpong P, Peerajan S, ChaiyasutC. Anti-Streptococcus mutans and anti-biofilm activities of dextranase and its encapsulation in alginate beads for application in toothpaste. PeerJ. 2020 Nov 17;8:e10165. doi: 10.7717/peerj.10165 28. Riley P, Moore D, Ahmed F, Sharif MO, Worthington HV. Xylitol-containing products for preventing dental caries in children and adults. cochrane database of systematic reviews. 2015 Mar 26;(3):CD010743. doi: 10.1002/14651858.CD010743.pub2
29. Furness S, Worthington HV, Bryan G, Birchenough S, McMillan R. Interventions for the management of dry mouth: topical therapies. cochrane database of systematic reviews. 2011 Dec 7;(12):CD008934. doi: 10.1002/14651858.CD008934.pub2
30. Rubido S, Fernández-Feijoo J, Limeres J, GarcíaCaballero L, Abeleira MT, Diz P. In vivo antiplaque effect of three edible toothpastes. Medicina oral, Patología oral y cirugía bucal. 2014 Jan 1;19(1):e88-92. doi: 10.4317/medoral.18973
31. Крайнюкова ЛА. Особенности факторов кариесрезистентности у больных атопическим дерматитом и их влияние на результаты химического отбеливания дисколоритов зубов. Диссертация на соискание ученой степени кандидата медицинских наук. Москва. 2019:172.
Актуальность. За последние два года в научной литературе опубликовано значительное количество данных о проявлении новой коронавирусной инфекции в полости рта во время заболевания. Однако имеются лишь единичные исследования по стоматологическому статусу у пациентов с постковидным синдромом. Цель исследования – определить индекс гигиены и некоторые показатели ротовой жидкости у пациентов с постковидным синдромом при использовании различных зубных паст.
Материалы и методы. Обследованы 68 пациентов в возрасте 27-40 лет, переболевших коронавирусной инфекцией не более чем за шесть месяцев до момента начала исследования. Группу контроля составили пациенты, не болевшие коронавирусной инфекцией. На первом этапе сравнивали некоторые показатели свойств и состава ротовой жидкости у пациентов, не болевших новой коронавирусной инфекцией с такими же показателями у пациентов, переболевших коронавирусной инфекцией и имеющих постковидный синдром. На втором этапе пациенты распределены по группам в зависимости от используемой зубной пасты. У всех пациентов определяли индекс гигиены полости рта и некоторые показатели ротовой жидкости.
Результаты. У пациентов с постковидным синдромом снижена скорость саливации, увеличена вязкость слюны, снижен минерализующий потенциал слюны, снижена активность лизоцима и уменьшена концентрация кателицидина LL-37 в ротовой жидкости. Установлено, что пациенты, использующие для ухода за полостью рта увлажняющую зубную пасту (R.O.C.S. Moisturizing), имели более высокие показатели скорости саливации, активности лизоцима, кателицидина LL-37, чем пациенты, использующие зубные пасты с хлоргексидином и лаурилсульфатом натрия. Также уровень гигиены полости рта у первой группы пациентов был достоверно выше.
Заключение. Установлено, что у пациентов с постковидным синдромом значительно изменены некоторые показатели ротовой жидкости. Достоверно выявлено, что на показатели оказывает влияние выбор зубной пасты. Для данной группы пациентов важно использовать зубную пасту, улучшающую свойства ротовой жидкости. Использование зубной пасты R.O.C.S. Moisturizing обеспечивает улучшение свойство ротовой жидкости у пациентов с постковидным синдромом.
Ключевые слова: постковидный синдром, ротовая жидкость, зубная паста, кателицидин LL-37.
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Появление COVID-19 в мире поставило перед специалистами разного профиля здравоохранения задачи, связанные не только с быстрой диагностикой и лечением, но и с оказанием качественной медицинской помощи, включающей реабилитационные мероприятия после и во время коронавирусной инфекции [1-19]. National Institute for Health and Care Excellence (NICE) в соглашении с Scottish Intercollegiate Guidelines Network и The Royal College of General Practitioners в своих рекомендациях 30 октября 2020 года впервые описали следующие формы COVID-19:
1) острый COVID-19 (acute COVID-19) – жалобы и симптомы COVID-19 продолжительностью до 4 недель;
2) продолжающийся симптоматический COVID-19 (ongoing symptomatic COVID-19) – жалобы и симптомы COVID-19 продолжительностью от 4 до 12 недель;
3) постковидный синдром (post-COVID-19 syndrome) — жалобы и симптомы, которые развиваются во время или после COVID-19 и длятся больше 12 недель и не являются результатом другого диагноза.
В МКБ-10 появился отдельный̆ код для описания постковидного синдрома (ПКС). Код U09.9 – Состояние после COVID-19. Этот код позволяет установить связь с COVID-19. Постковидный синдром, скорее всего, не является уникальным явлением и совпадает по своим клиническим проявлениям с миалгичесим энцефаломиелитом (синдром хронической усталости) [19-20], постинфекционными состояниями. Скорее всего, и другие известные постинфекционные осложнения могут иметь общую природу, которые проявляется частыми головными болями, астеническим синдромом с эмоциональной лабильностью, гневливостью, злобностью, агрессивностью, головокружениями и шаткостью походки, забывчивостью, замедленностью темпа мышления, снижением внимания, расстройствами памяти, невозможностью выполнять повседневные обязанности, возникновением зависимости от близких, оскуднением словесного запаса, потерей интереса к традиционным увлечениям, сужением круга общения [20].
За последние два года в научной литературе опубликовано значительное количество данных о проявлении новой коронавирусной инфекции в полости рта во время заболевания. Однако имеются лишь единичные исследования по стоматологическому статусу у пациентов с постковидным синдромом.
Смешанная слюна (ротовая жидкость) является естественной реминерализирующей жидкостью и играет важнейшую роль в формировании резистентности зубов к кариозному поражению за счет поддержания физиологического равновесия процессов ре- и деминерализации в эмали. Состав и свойства ротовой жидкости, безусловно, влияют на стоматологический статус пациента [19-24].
Кателицидин LL-37 – вещество, которое синтезируется в кератиноцитах, нейтрофилах в виде неактивного предшественника, состоящего из N-концевого кателинподобного и С-концевого антимикробного доменов. Кателицидин LL-37 обладает противовирусными, противогрибковыми и антибактериальными свойствами за счет электростатического взаимодействия с мембранами клеток. Концентрация пептида LL-37 растет при повреждениях кожи или слизистых оболочек в различных стрессовых ситуациях, что позволяет отнести его к сигналам тревоги [25].
Многими исследователями установлено влияние зубных паст на состав и свойства ротовой жидкости. Установлено, что зубные пасты с растительными экстрактами, не содержащие лаурилсульфат натрия, благотворно влияют на состояние полости рта [26-30].
Цель исследования – определить индекс гигиены и некоторые показатели ротовой жидкости у пациентов с ПКС при использовании различных зубных паст.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Нами обследованы 68 пациентов в возрасте 27-40 лет, переболевших коронавирусной инфекцией не более чем за шесть месяцев до момента начала исследования. Группу контроля составили пациенты, не болевшие коронавирусной инфекцией (16 человек). Полость рта у всех пациентов была санирована, интенсивность кариеса находилась в пределах от 7 до 13. На момент осмотра в полости рта у пациентов не было воспалительных заболеваний. У всех пациентов показатели индекса гигиены были сопоставимы. Пищевые привычки были приблизительно одинаковыми. Со слов пациентов, соматические патологии отсутствуют, вредные привычки отрицают.
На первом этапе сравнивали некоторые показатели свойств и состава ротовой жидкости у пациентов, не болевших новой коронавирусной инфекцией с такими же показателями у пациентов, переболевших коронавирусной инфекцией и имеющих ПКС.
Распределение в группы на втором этапе исследования происходило на основании анкетных данных и завесило от используемой зубной пасты на протяжении шести месяцев после заболевания.
В первую группу вошли 24 пациента с постковидным синдромом, использовавшие увлажняющую зубную пасту R.O.C.S. Moisturizing (зубная паста не содержит хлоргексидина и лаурилсульфата).
Вторую группу составил 21 пациент, использовавший зубную пасту с хлоргексидином (зубные пасты не содержали лаурилсульфата натрия). 23 пациента третьей группы использовали зубную пасту с лаурилсульфатом (sodium lauryl sulfate).
В течение периода заболевания все пациенты, переболевшие коронавирусной инфекцией, использовали одинаковую схему лечения, включая антикоагулянты, антибиотики, витамины. У всех пациентов был зарегистрирован врачом-терапевтом ПКС (МКБ-10 U09.9 Состояние после COVID-19 неуточненное), который характеризовался следующими симптомами, подтвержденными анкетными данными: нарушение общего самочувствия, приступы слабости, снижение толерантности к физическим нагрузкам, боли в мышцах, суставах, головные боли, парестезии, нарушение ритмов жизнедеятельности, одышка.
Всем пациентам был проведен осмотр один раз через шесть месяцев от начала заболевания коронавирусной инфекцией и дополнительные осмотры в течение срока наблюдения. Скорость саливации слюны (СС) определяли по методике Рединовой Т. Л., Поздеева А. Р. (1994) путем сбора в стерильные мерные пробирки. Слюну собирали обычно в течение 5-15 минут. Пациенту предлагалось наклонить подбородок вниз к груди.
Скорость саливации определялась по следующей формуле:
СС = V / t (мл/мин),
где V – объем выделенной слюны в мл; t – время сбора слюны в минутах.
Вязкость смешанной слюны определяли по упрощенной методике Рединовой – Поздеева (1994) в относительных единицах. Норма вязкости смешанной слюны: 1,2-2,4 сП.
Активность лизоцима (АЛ) в ротовой жидкости определяли фотонефелометрическим методом Дорофейчук В. Г. (1968) на спектрофотометре «PV 1251 С». Из тест-культуры m. Lysodeikticus готовили взвесь в фосфатном буфере рН = 7,2-7,4. Далее фильтровали и стандартизировали по ФЭК56 при использовании зеленого светофильтра (длина рабочей волны Л = 540 нм) в кювете с рабочей длиной 3 мм. При нефелометрии светопропускание исходной взвеси доводили до 20% (4 млрд бактерий). К 1,47 мл приготовленной микробной взвеси добавляли 0,03 мл исследуемого субстрата. Пробирки выдерживали при температуре +37 °С в течение 60 минут и проводили нефелометрию при тех же условиях, которые соблюдали при стандартизации исходной взвеси. Для определения процента активности лизоцима из процента светопропускания испытуемой взвеси вычитали процент светопропускания исходной микробной взвеси (20%). Исследуемая слюна разводилась фосфатным буфером в соотношении 1:20.
Определение рН ротовой жидкости проводилось при помощи индикаторных полосок бумаги (ФАН) с интервалом рН 5,4-7,8, шагом 0,2.
Для определения минерализующего потенциала слюны использовали индекс МПС (3) по Леусу (1977 г.) На предметное стекло, предварительно обработанное спиртом и эфиром, наносили не менее трех капель ротовой жидкости. Микропрепараты высушивали при комнатной температуре. Высохшие капли изучали под микроскопом в отраженном свете при небольшом увеличении. Характер рисунка на стекле оценивали по 5-балльной шкале в зависимости от выявленных типов кристаллообразования: 0 баллов – полное отсутствие кристаллов в поле зрения; 1 балл – по всей площади капли обнаруживается большое количество равномерно расположенных структур неправильной формы; 2 балла – кристаллы различной формы располагаются равномерно в виде сеточки по всему полю или сгруппированы по периферии капли, а в поле зрения находится много органического вещества; 3 балла – в центре капли располагаются отдельные дендритные кристаллопризматические структуры, а по периферии находится большое число призматических структур неправильной формы; 4 балла – в центре капли обнаруживается четкий рисунок крупных удлиненных кристаллопризматических структур, сросшихся между собой и имеющих древовидную или папоротникообразную форму, в то время как органическое вещество располагается в небольшом количестве по периферии, 5 баллов – по всей капле определяется четкий рисунок крупных удлиненных кристаллопризматических структур.
Содержание кателицидина LL-37 в ротовой жидкости определяли методом иммуноферментного анализа [31].
Индекс гигиены определяли по O’Leary путем окрашивания всех зубов и расчета процентного отношения окрашенных поверхностей (O’Leary T., Drake R., Naylor, 1972). Обработку результатов проводили c использованием программы Statistica 10,0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате исследования установлено, что скорость саливации у пациентов с постковидным синдромом составляет 0,41 ± 0,03 мл/мин, у пациентов, не болевших новой коронавирусной инфекцией, показатель составил 0,54 ± 0,02 мл/мин (табл. 1).

Значение показателя вязкости слюны у пациентов, имеющих постковидный синдром, было 1,98 ± 0,04 отн. ед. Данный показатель у пациентов, не болевших новой коронавирусной инфекцией, составил 1,43 ± 0,03 отн. ед. (табл. 1).
Значение показателя pH ротовой жидкости у пациентов с постковидным синдромом составило 6,95 ± 0,16, тогда как у не болевших пациентов показатель был 7,12 ± 0,15 (табл. 1).
Показатель минерализующего потенциала слюны (МПС) у пациентов, имеющих посковидный синдром, составил 1,2 6± 0,06 баллов. Значение МПС у пациентов, не болевших коронавирусной инфекцией, было 2,34 ± 0,08 баллов.
В результате исследования показатели активности лизоцима в ротовой жидкости у пациентов с постковидным синдромом составили 32,26 ± 2,09%, у пациентов, не болевших новой коронавирусной инфекцией, значение было 41,64 ± 3,18% (табл. 1).
Концентрация кателицидина в ротовой жидкости у пациентов с постковидным синдромом составила 13,43 ± 1,26 мкг/мл, у не болевших пациентов – 29,42 ± 2,47 мкг/мл. Индекс гигиены у пациентов с постковидным синдромом был значительно хуже по сравнению с показателем у пациентов, не имеющих данного синдрома (табл. 1).
В результате исследования установлено, что скорость саливации у пациентов с постковидным синдромом, использовавших зубную пасту R.O.C.S. Moisturizing, составила 0,56 ± 0,03 мл/мин, у пациентов, использовавших зубную пасту с хлоргексидином, данный показатель был 0,32 ± 0,02 мл/мин. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели скорость саливации 0,31 ± 0,09 мл/мин (табл. 2).
Значение показателя вязкости слюны у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing было 1,12 ± 0,05 отн. ед. Данный показатель у пациентов, использовавших зубную пасту с хлоргексидином, составил 1,96 ± 0,04 отн. ед. В результате исследования выявлено, что вязкость слюны у пациентов, использовавших пасту с лаурилсульфатом натрия, была 2,08 ± 0,05 отн. ед.
В результате исследования, значение показателя pH ротовой жидкости у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing составило 7,24 ± 0,18, тогда как у пациентов, использовавших зубную пасту с хлоргексидином данный показатель был 6,12 ± 0,12. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели pH ротовой жидкости 6,35 ± 0,27.
Показатель минерализующего потенциала слюны (МПС) у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing, составил 2,24 ± 0,07 баллов. Значение МПС у пациентов, использовавших зубную пасту с хлоргексидином, было 1,32 ± 0,17 баллов. В результате исследования выявлено, что показатель МПС у пациентов, использовавших пасту с лаурилсульфатом натрия, в среднем был 1,67 ± 0,05 балла.
Показатели активности лизоцима в ротовой жидкости у пациентов, использовавших зубную пасту R.O.C.S. Moisturizing, составили 42,23 ± 2,65%, у пациентов, использовавших зубную пасту с хлоргексидином, данные значения были в пределах 31,42 ± 3,09%. Пациенты, использовавшие зубную пасту с лаурилсульфатом натрия, имели показатель активности лизоцима 34,12 ± 2,72%.
Концентрация кателицидина в ротовой жидкости у пациентов, использовавших зубную пасту, составила R.O.C.S. Moisturizing 27,43 ± 1,38 мкг/мл, у пациентов, использовавших зубную пасту с хлоргексидином, – 12,32 ± 2,63 мкг/мл. В результате исследования выявлено, что концентрация кателецедина в ротовой жидкости у пациентов, использовавших пасту с лаурилсульфатом натрия, составила 16,38 ± 2,19 мкг/мл.
Индекс гигиены у пациентов, использующих зубную пасту R.O.C.S. Moisturizing в течение трех месяцев, был значительно лучше, чем у пациентов, использующих пасты с хлоргексидином и лаурилсульфатом натрия (табл. 2).
ЗАКЛЮЧЕНИЕ
Установлено, что у пациентов с постковидным синдромом значительно изменены некоторые показатели ротовой жидкости. Достоверно выявлено, что на показатели оказывает влияние выбор зубной пасты. Использование зубной пасты R.O.C.S. Moisturizing обеспечивает улучшение свойств ротовой жидкости у пациентов с постковидным синдромом.
СПИСОК ЛИТЕРАТУРЫ
1. Amorim Dos Santos J, NormandoAGC, Carvalho da Silva RL, Acevedo AC, De Luca Canto G, Sugaya N, et al. Oral Manifestations in Patients with COVID-19: A Living Systematic Review. Journal of Dental research. 2021 Feb;100(2):141-154. doi:10.1177/0022034520957289
2. Ather A, Patel B, Ruparel NB. Coronavirus disease 19 (COVID-19): implications for clinical dental care. Journal of endodontics. 2020;46:584-595. doi:10.1016/j.joen.2020.03.008
3. Bidra AS, Pelletier JS, Westover JB, Frank S, Brown SM, Tessema B.J Comparison of In Vitro Inactivation of SARS CoV-2 with Hydrogen Peroxide and Povidone-Iodine Oral Antiseptic Rinses. Journal of Prosthodontics. 2020 Aug;29(7):599-603. doi:10.1111/jopr.13220
4. Burton MJ, Clarkson JE, Goulao B, Glenny AM, McBain AJ, Schilder AG, Webster KE, et al. Antimicrobial mouthwashes (gargling) and nasal sprays administered to patients with suspected or confirmed COVID-19 infection to improve patient outcomes and to protect healthcare workers treating them. cochrane Database of Systematic reviews. 2020 Sep 16;9(9):CD013627. doi: 10.1002/14651858.CD013627.pub2
5. Peng X, Xu X, Li Y. Transmission routes of 2019-nCoV and controls in dental practice. international Journal of oral Science. 2020;12:9. doi:10.1038/s41368-020-0075-9
6. Cox-Georgian D, Ramadoss N, Dona C. Therapeutic and medicinal uses of terpenes. In: Joshee N, Dhekney SA, Parajuli P, editors. Medicinal plants: from farm to pharmacy. 2019:333-359. doi: 10.1007/978-3-030-31269-5_15
7. Dominiak M, Shuleva S, Silvestros S. A prospective observational study on perioperative use of antibacterial agents in implant surgery. advances in clinical and experimental Medicine. 2020;29:355-363. doi:10.17219/acem/115087
8. Levy E, Delvin E, Marcil V. Can phytotherapy with polyphenols serve as a powerful approach for the prevention and therapy tool of novel coronavirus disease 2019 (COVID-19)? aJP endocrinology and Metabolism. 2020;319(4):E689-E708. doi:10.1152/ajpendo.00298.2020
9. Marui VC, Souto MLS, Rovai ES. Efficacy of preprocedural mouthrinses in the reduction of microorganisms in aerosol: a systematic review. Journal of the american Dental association. 2019;150:1015-1026.e1. doi:10.1016/j.adaj.2019.06.024
10. Mateos-Moreno MV, Mira A, Ausina-Márquez V, Ferrer MD Oral antiseptics against coronavirus: in-vitro and clinical evidence. the Journal of hospital infection. 2021 Jul;113:30-43. doi:10.1016/j.jhin.2021.04.004
11. Math MV, Kattimani YR, Gadda RB, Khadkikar RM. Plant products in reducing spread of coronavirus infection (COVID-19). british Journal of oral and Maxillofacial Surgery. 2021 May;59(4):497-498. doi: 10.1016/j.bjoms.2020.11.005
12. Seneviratne CJ, Balan P, Ko KKK, Udawatte NS, Lai D, Ng DHL, Venkatachalam I, et al. Efcacy of commercial mouth-rinses on SARS-CoV-2 viral load in saliva: randomized control trial in Singapore. infection. 2021 Apr;49(2):305-311. doi:10.1007/s15010-020-01563-9
13. Vergara-Buenaventura A, Castro-Ruiz C. Use of mouthwashes against COVID-19 in dentistry. british Journal of oral and Maxillofacial Surgery. 2020 Oct;58(8):924-927. doi: 10.1016/j.bjoms.2020.08.016
14. Рекомендации по ведению больных с коронавирусной инфекцией COVID-19 в острой фазе и при постковидном синдроме в амбулаторных условиях. Под ред. проф. Воробьева П.А. Проблемы стандартизации в здравоохранении. 2021;7-8:3-96. Режим доступа: https://doi.org/10.26347/1607-2502202107-08003-096
15. Сатыго ЕА, Бакулин ИГ. Клинические и микробиологические признаки кандидоза полости рта у пациентов с COVID-19, получающих различную патогенетическую терапию и имеющих разный уровень гигиены полости рта. Пародонтология. 2021;26(1):4-8. doi: https://doi.org/10.33925/1683-3759-2021-26-1-4-8
16. Силин АВ, Зуева ЛП, Сатыго ЕА, Молчановская МА. Эпидемиологические особенности и инфекционный контроль при COVID-19 в стоматологической практике (научный обзор). Профилактическая и клиническая медицина. 2020;2(75):5-10. Режим доступа: https://profclinmed.szgmu.ru/PIK_2-2020.pdf
17. Barker-Davies RM, O’Sullivan O, Senaratne KPP, Baker P, Cranley M, Dharm-Datta S, Ellis H, et al. The Stanford Hall consensus statement for post-COVID-19 rehabilitation. british Journal of Sports Medicine. 2020 Aug;54(16):949-959. doi: 10.1136/bjsports-2020-102596
18. Kamal M, Abo Omirah M, Hussein A, Saeed H. Assessment and characterisation of post-COVID-19 manifestations. international Journal of clinical Practice. 2021 Mar;75(3):e13746. doi:10.1111/ijcp.13746
19. Pedersen AML, Sørensen CE, Proctor GB, Carpenter GH, EkströmJ. Salivary secretion in health and disease. Journal of oral rehabilitation. 2018 Sep;45(9):730-746. doi:10.1111/joor.12664
20. Carpenter GH. The secretion, components, and properties of saliva. annual review of Food Science and technology. 2013;4:267-76. doi: 10.1146/annurev-food-030212-182700
21. Mikhaylenko TN, Ernestyuk AM, Rozhko NM. The dynamics of changes in rheological properties of oral fluid in patients with different levels of oral hygiene, using removable dentures. Georgian Medical news. 2014 Dec;(237):19-24.
22. Roblegg E, Coughran A, SirjaniD. Saliva: An all-rounder of our body. european Journal of Pharmaceutics and biopharmaceutics. 2019 Sep;142:133-141. doi: 10.1016/j.ejpb.2019.06.016
23. Gray-Stuart EM, Jones JR, BronlundJE. Defining the end-point of mastication: A conceptual model. Journal of texture Studies. 2017 Oct;48(5):345-356. doi: 10.1111/jtxs.12253
24. Zhao Y, Yin LY, Bi RR, Ma P, Li SB. Current advance in saliva-derived exosome study. Zhonghua Kou Qiang Yi Xue Za Zhi. chinese journal of stomatology. 2016;Dec;9;51(12):765-769. doi: 10.3760/cma.j.issn.1002-0098.2016.12.012
25. Тырнова ЕВ, Алешина ГМ, Янов ЮК, Кокряков ВН. Оценка экспрессии генов кателицидина ll-37 и бетадефенсинов-1, -2, -3 человека в слизистой оболочке среднего уха при хронических воспалительных заболеваниях. Современные проблемы науки и образования. 2017;5:106. Режим доступа: https://elibrary.ru/item.asp?id=30457909
26. Janakiram C, Venkitachalam R, Fontelo P, Iafolla TJ, Dye BA. Effectiveness of herbal oral care products in reducing dental plaque & gingivitis – a systematic review and meta-analysis. bMc complementary Medicine and therapies. 2020 Feb 11;20(1):43. doi: 10.1186/s12906-020-2812-1
27. Juntarachot N, Sirilun S, Kantachote D, Sittiprapaporn P, Tongpong P, Peerajan S, ChaiyasutC. Anti-Streptococcus mutans and anti-biofilm activities of dextranase and its encapsulation in alginate beads for application in toothpaste. PeerJ. 2020 Nov 17;8:e10165. doi: 10.7717/peerj.10165 28. Riley P, Moore D, Ahmed F, Sharif MO, Worthington HV. Xylitol-containing products for preventing dental caries in children and adults. cochrane database of systematic reviews. 2015 Mar 26;(3):CD010743. doi: 10.1002/14651858.CD010743.pub2
29. Furness S, Worthington HV, Bryan G, Birchenough S, McMillan R. Interventions for the management of dry mouth: topical therapies. cochrane database of systematic reviews. 2011 Dec 7;(12):CD008934. doi: 10.1002/14651858.CD008934.pub2
30. Rubido S, Fernández-Feijoo J, Limeres J, GarcíaCaballero L, Abeleira MT, Diz P. In vivo antiplaque effect of three edible toothpastes. Medicina oral, Patología oral y cirugía bucal. 2014 Jan 1;19(1):e88-92. doi: 10.4317/medoral.18973
31. Крайнюкова ЛА. Особенности факторов кариесрезистентности у больных атопическим дерматитом и их влияние на результаты химического отбеливания дисколоритов зубов. Диссертация на соискание ученой степени кандидата медицинских наук. Москва. 2019:172.
Характеристики
|
Автор книги
|
Е.А. Сатыго, И.Г. Бакулин, А.П. Лимина |
|
Год выпуска
|
2021 |
Задать вопрос
Задать вопрос
Новости
Все новости
20 октября 2023
Кредит на образование с господдержкой




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
