О ВЛИЯНИИ НАПИТКОВ И ПИТЬЕВОЙ ВОДЫ НА МЕХАНИЧЕСКИЕ СВОЙСТВА ЗУБНОЙ ЭМАЛИ
Муслов С.А.1, Бабайцева Л.А.2, Хасанов Ф.К.1
1 Московский государственный медико-стоматологический университет им. А.И. Евдокимова
г. Москва, РФ; e-mail: muslov@mail.ru
2 Стоматологическая поликлиника №61 Департамента здравоохранения г. Москвы
г. Москва, РФ
Поступила в редакцию: 14.07.20
Аннотация. За последние 10 лет продажи фруктовых соков и газированных напитков выросли на 55% и по оценкам будут расти примерно на 2-3% в год. Ряд кислых фруктовых соков и напитков, которые являются частью повседневного рациона питания, являются причинами разрушения структуры зубов и снижения показателей упругости и твердости их поверхности. В данной работе выполнен обзор литературных данных по влиянию среды полости рта и напитков, а также средств гигиены на основные механические свойства эмали зубов (модуль упругости, твердость и шероховатость).
Ключевые слова: продукты, напитки, механические свойства, модуль Юнга, твердость, шероховатость, эрозия, эмаль зуба.
Из всей совокупности показателей механических свойств, характеризующих сопротивление материалов воздействующей на них упругопластической нагрузке, упругие модули и твердость одни из самых чувствительных к изменению структуры вещества. Их изучение всегда вызывает повышенный интерес у исследователей и практикующих врачей-стоматологов. Как известно модуль упругости – общее название нескольких физических величин, отражающих способность твердых тел упруго деформироваться под действием внешних сил. Наиболее распространен и является основным модуль Юнга (соответствующий деформации растяжения-сжатия). Часто модуль Юнга называют просто модулем упругости [4]. Твердость – это сопротивление твердого тела упругой деформации, пластической деформации и разрушению в поверхностном слое при силовых воздействиях на него и функционально крайне важный параметр механических характеристик зубной эмали. Оба показателя измеряются в Па=Н/м2, однако имеются существенные различия между этими двумя понятиями. Если при исследовании упругих свойств материал деформируется только упруго, то при тестировании на твердость в процессе увеличения нагрузки образец проходит три стадии: упругую деформацию, пластическую деформацию и разрушение. Таким образом, определение механических свойств по твердости содержит дополнительную информацию, а физическая теория твердости определяется зависимостями, связывающими её с характеристиками упругости, пластичности и разрушения. Микротвердостъю называют твердость отдельных участков микроструктуры материала, фаз и структурных составляющих (1 мкм=10-6 м). Нанотвердость – твердость наноразмерных объектов (1 нм=10-9 м). Как известно, резистентность зубов определяется различными свойствами эмали, одним из которых является твердость. В свою очередь в возникновении кариозного процесса немаловажную роль отводится резистентности эмали зуба [3].
В [21] Lussi A. et al., 1995 в своей статье, опубликованной в журнале “Caries Research”, сообщили, что яблочный сок вызывает наибольшее значительное снижение (p<0,05) микротвердости эмали, после него следовали безалкогольные напитки Schweppes, Orangina и Grapefruit. Наименьшее снижение поверхностной микротвердости, которое было статистически значимым, было вызвано применением Fendant и Isostar orange. Среднее абсолютное отклонение рассчитанной эффективной эрозии составило 7,1%, оно варьировалось от 14,6% (яблочный сок) до 1,6% (Fendant). Исследовали щечные поверхности 84 премоляров без кариеса, залитых смолой и отполированных, при этом 200 микрометров поверхности эмали были удалены. Образцы погружались на 20 минут в напитки. Микротвердость поверхности измеряли до и после погружения.
Целью исследования [22] Lussi A. et al., 2000 было сравнение эрозионного потенциала различных напитков и пищевых продуктов. Шестьдесят временных и 60 постоянных зубов человека были погружены на 3 мин в исследуемые растворы (5 зубов на группу). Микротвердость поверхности эмали зубов измеряли до и после воздействия. Базовая поверхностная микротвердость была ниже для временных зубов, чем для постоянных. Как во временных, так и в постоянных зубах Sprite продемонстрировал наибольшее снижение микротвердости поверхности, тогда как йогурт показал увеличение микротвердости поверхности временных зубов. Общее снижение составило 27,2 +/- 17,5 KHN (среднее +/- SD) для временных и 25,9 +/- 15,6 KHN для постоянных зубов (KHN – единица измерения твердости по Кнупу). Сравнение восприимчивости к эрозии в этой модели in vitro показало, что временные зубы не были более подвержены эрозии по сравнению с постоянными зубами.
Авторы Zero DT et al., 1996 [31] среди других уделяют диетологическим факторам при анализе эрозии зубов первостепенное внимание, при этом общий уровень кислоты пищевых веществ авторы считают не менее важным, чем их pH, поскольку он определяет фактический уровень H+, доступный для взаимодействия с веществом поверхности зуба. Другие составляющие пищевых продуктов и напитков также оказывают модифицирующее действие на поверхность, включая кальций, фосфаты и фториды, также имеет значение тип кислоты.
Edwards M. и соавт., 1999 [14] обнаружили, что фруктовые газированные напитки имеют больший эрозионный потенциал, чем другие газированные напитки, а ароматизированные воды обладают таким же эрозионным потенциалом, что и фруктовые газированные напитки. В рамках исследования были протестированы следующие группы напитков: чистые фруктовые соки, газированные напитки не на фруктовой основе, газированные напитки на фруктовой основе, ароматизированные родниковые воды и обычные газированные минеральные воды.
Когда к Coca-Cola® добавляли лактат кальция (донор кальция), у крыс значительно уменьшалась эрозия зубов по сравнению с неизмененным Coca-Cola® после 5 недель контакта с ней (Beiraghi S. et al., 1989 [10]). Усилия по защите зубов от эрозивных веществ включали в себя снижение потребления кислой пищи и газированных напитков (Dodds M. et al., 1997 [13], Maupome G. et al, 1998 [25]). При этом в [23] отмечали, что кислотный эффект газированных напитков в основном обусловлен фосфорной кислотой.
Температура и время воздействия влияют на механические свойства эмали человека (West NX et al., 2000 [29], Eisenburger M et al., 2003 [15], Barbour ME et al., 2006 [9]). В [15] подчеркнуто, что эрозия и размягчение эмали основаны на химических процессах, на которые могут влиять многие факторы, включая температуру и скорость кислотного потока. Выявлена сильная зависимость эрозии от потока жидкости. Глубина эрозии значительно увеличивалась при температуре кислоты с 11,0 микрон при 4 градусах C до 35,8 микрон при 50 градусах. Результаты [28] также показали, что повышение температуры, концентрации и времени воздействия увеличивало эрозию дентина и эмали. Образцы помещали в лимонную, молочную, яблочную или фосфорную кислоты. Авторы [9] указывают, что исследования эрозивного потенциала безалкогольных напитков обычно проводятся при комнатной температуре или температуре тела, но напитки чаще подают охлажденными, со льдом или горячими. Поскольку скорость химических реакций обычно увеличивается с ростом температуры, предсказывалось, что эрозия более сильная при высоких температурах и уменьшается при низких температурах. Атомно-силовая микроскопия, наноиндентирование и бесконтактная оптическая профилометрия были использованы для оценки изменений наномеханических свойств эмали через 5 минут и потери эрозионного материала через 30 минут при воздействии двух разных негазированных безалкогольных напитков при 4, 25, 50 и 75 °С. Для одного напитка (сокосодержащий напиток Robinson's Original Juice Drink) была установлена статистически значимая разница между наномеханическими свойствами и глубиной эрозии при всех температурах, причем размягчение и эрозия увеличивались с ростом температуры. Что касается другого напитка (сока Ribena ToothKind Juice Drink), то произошло небольшое размягчение и практически не было потери материала, а температура не оказала статистически значимого влияния на эрозию. Наблюдалась сильная линейная корреляция (R2 = 0,94) между наномеханическими свойствами и потерей материала. Разницу между напитками можно объяснить их составом. Для эрозионного напитка потеря материала увеличилась, а нанотвердость уменьшилась, приблизительно линейно с температурой.
Продукты из цитрусовых широко распространены в современных диетах. Цитрусовые содержатся в ежедневном рационе многих людей, среди них наиболее распространены апельсин, мандарин, лимон, грейпфрут, лайм и др. Большая часть экспериментальных работ по определению влияния цитрусовых на эмаль сосредоточена на напитках. Исследования показали, что существует сильная корреляция между употреблением в пищу цитрусовых конфет, цитрусовых безалкогольных напитков и деградацией эмали.
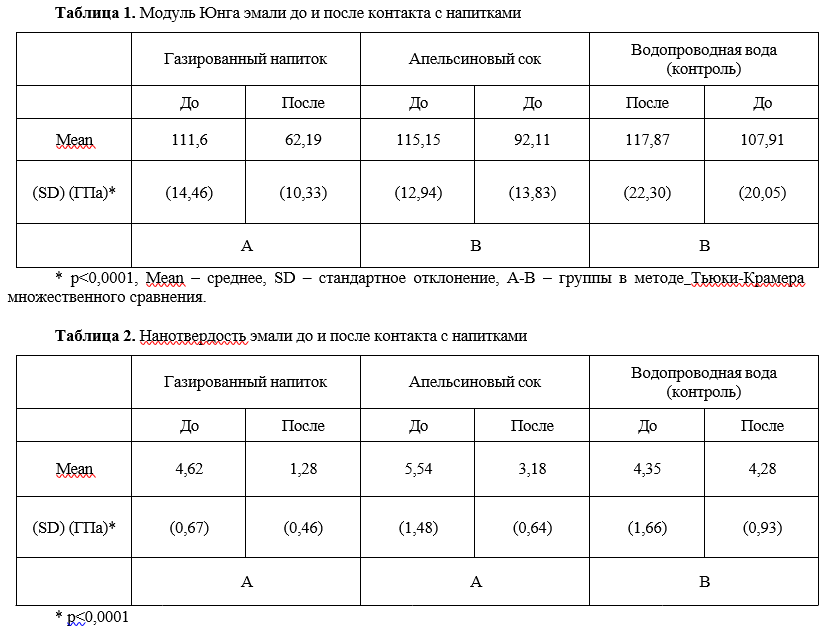
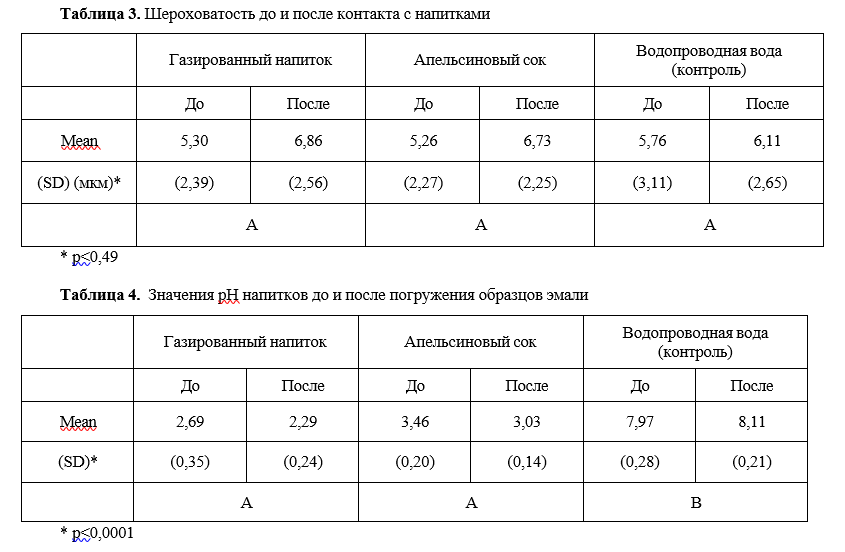
В следующем, тщательно выполненном исследовании (Machado C. et al., 2008 [23]) оценивали модуль упругости, нанотвердость, шероховатость поверхности эмали человека после контакта с цитрусовыми напитками. Образцы эмали были распределены на 3 группы в зависимости от типа используемого напитка: газированный напиток (Sprite®), апельсиновый сок и водопроводная вода (контроль). Шероховатость поверхности оценивали с помощью профилометра, а нанотвердость и модуль упругости регистрировали с использованием наноиндентора. Величину pH напитков измеряли до и после контакта с лимонной кислотой в течение 5 недель. Применяли специальный статистический тест. Средние значения и стандартные отклонения показателей механических свойств эмали (SD) оказались следующими.
Газированный напиток: модуль упругости снизился с 111,6 (14,5) до 62,2 (10,3) ГПа, нанотвердость снизилась с 4,62 (0,67) до 1,28 (0,46) ГПа, шероховатость увеличилась с 5,30 (2,39) до 6,86 (2,56) мкм и рН изменился с 2,69 (0,35) до 2,29 (0,24).
Апельсиновый сок: модуль упругости изменился с 115,15 (12,94) до 92,11 ГПа (13,83), нанотвердость с 5,54 (1,48) до 3,18 ГПа (0,64), шероховатость с 5,26 (2,27) до 6,73 (2,25) мкм и рН с 3,46 (0,20) до 3,03 (0,14).
Водопроводная вода (контроль): модуль упругости изменился с 117,87 (22,3) до 107,91 (20,05) ГПа, нанотвердость с 4,35 (1,66) до 4,28 (0,93) ГПа, шероховатость с 5,76 (3,11) до 6,11 (2,65) мкм и pH с 7,97 (0,28) до 8,11 (0,21) (табл. 1-3).
Таким образом, авторами установлено, что воздействие безалкогольных напитков вызывает значительное снижение модуля упругости и нанотвердости. Апельсиновый сок, что удивительно, оказал меньшее влияние на твердость, модуль упругости и шероховатость эмали, чем газированный напиток.
Проведенные исследования позволили авторам сделать следующие выводы:
1. Нанотвердость зубной эмали значительно уменьшилась примерно до 1/3 и 1/2 от его первоначального значения после контакта с газированным безалкогольным напитком и апельсиновым соком, соответственно.
2. Модуль упругости эмали уменьшился больше в газированном напитке, чем в апельсиновом соке.
3. Воздействие безалкогольного напитка или апельсинового сока в течение 5 недель существенно не повлияло на целостность поверхности эмали при профилометрическом измерении шероховатости эмали.
4. Уровень рН безалкогольного напитка и сока упал от низкого до очень низкого (кислотные значения) при изменении температуры от 5° С до 37° С.
Отметим также, что значения модуля Юнга, нанотвердости и шероховатости зубной эмали, полученные в данной работе хорошо согласуются с данными, сообщенными авторами обзора в [1, 2].
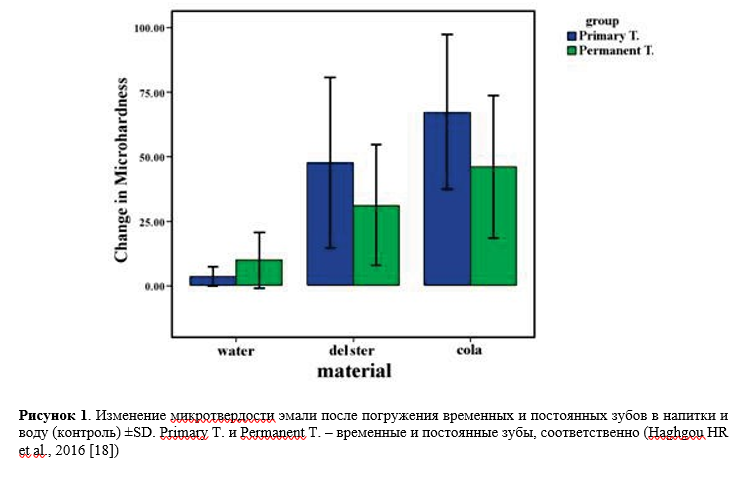
Сообщалось и о других подобных исследованиях, например, выполненных в (Haghgou HR et al., 2016 [18]). Авторы утверждают, что потребление газированных напитков является одним из этиологических факторов, вызывающих эрозию зубов. Целью их исследования было сравнение изменений микротвердости постоянных и временных зубов после погружения в два типа газированных напитков Lemon Delster и Coca-Cola (рис. 1). Как известно, среди ингредиентов Coca-Cola присутствуют: aqua carbonated (газированная вода), сахар, ароматизаторы, кофеин, красители, кислоты (цикламовая кислота и её натриевые, калиевые и кальциевые соли – E952, ортофосфорная H3PO4 – E338, лимонная – Е330, бензойная – Е210) и другое. Исследование было проведено на 30 здоровых постоянных молярах и 30 здоровых временных клыках. Каждая группа временных и постоянных зубов была разделена на три группы по 10 зубов. Зубы погружали в 40 мл каждого из двух напитков и воду на 5 минут. Одна подгруппа была погружена в воду (в качестве контроля). Следующая была погружена в Lemon Delster, а последняя подгруппа была погружена в Coca-Cola. Микротвердость эмали измеряли по методу Виккерса до и после погружения. Данные были проанализированы с помощью парного t-критерия и одностороннего дисперсионного анализа. Снижение микротвердости в временных зубах было значительным как в группах Lemon Delster, так и в группе Coca-Cola (р<0,05). Это снижение также было статистически значимым в постоянных зубах (p<0,05). Сравнение изменений эмали в временных зубах с таковыми в постоянных зубах после погружения в оба напитка показало большее снижение микротвердости в временных зубах в обеих экспериментальных группах. По результатам исследования авторы сделали вывод, что Coca-Cola и Lemon Delster вызывали значительное снижение микротвердости зубной эмали. Это уменьшение было больше во временных зубах, чем в постоянных зубах и было также больше после погружения в Coca-Cola, чем после погружения в Lemon Delster.
West et al. измеряли влияние кислот и рН на эрозию дентина и эмали и показали, что лимонная кислота с более высоким pH продемонстрировала более низкую эрозионную способность, чем фосфорная кислота с более низким рН (West NX et al., 2001 [30]). Потерю ткани рассчитывали по профилометрии. При этом авторы указывают, что лимонная и фосфорная кислоты являются двумя основными пищевыми кислотами, присутствующими в кислых безалкогольных напитках. Эти факторы могут быть рассмотрены с целью снижения эрозивности кислых безалкогольных напитков.
Тем временем Lippert et al., 2004 [20] установили, что эффект смягчения эмали лимонада и колы, которые содержат фосфорную кислоту, сильнее, чем влияние фруктовых соков, содержащих лимонную кислоту. Эти результаты находятся в соответствии с результатами (Haghgou HR et al., 2016 [18]).
Fallahinejad и соавт. заявили, что кислые напитки вызывают у зубов большую потерю кальция, чем стандартные и контрольные растворы. Они сравнивали 4 вида напитков с 4 стандартными растворами с одной и той же кислотой и pH как у напитков. Это указывало на то, что газы и другие ингредиенты в напитках, такие как сахар, могут увеличить эффект эрозии в напитках больше, чем простая кислота (Fallahinejad G. et al., 2007 [16]). В этом исследовании для измерения количества выхода кальция использовались спектрометрия и фотометрия.
Ganss C. et al. и Schlueter N. et al. использовали профилометрический метод для исследования влияния кислоты на зубную ткань путем измерения шероховатости алмазным зондом. Контакт с кислотными растворами приводил к снижению в микротвердости эмали и потере поверхностных тканей (Ganss C. et al. 2005 [17], Schlueter N. et al., 2011 [27]).
Meurman JH et al., 1991 в тестах in vitro [26] обнаружили, что нешлифованная эмаль менее подвержена эрозии в Coca-Cola, содержащей фосфорную кислоту (pH 2,6), и спортивных напитках, содержащих лимонную или яблочную кислоту (pH 2,8 и 3,4, соответственно) в течение 15-180 мин., чем полированная алмазной пастой эмаль. Эрозию эмали человека и бычьей эмали исследовали с помощью сканирующего электронного микроскопа.
Патологическому влиянию Coca-Cola и воздействию искусственной слюны на твердость эмали зубов были посвящены работы Devlin H. et al. (2006) [12] и Tantbirojn D. et al. (2008) [28]. Цель исследования Devlin H. et al. (2006) состояла в том, чтобы определить скорость изменения твердости эмали индентированием постоянных зубов, подвергшихся воздействию Coca-Cola. В следующем эксперименте была проверена способность искусственной слюны реминерализовать эмаль, обработанную Coca-Cola. Десять образцов эмали были отобраны случайным образом для обработки Coca-Cola (экспериментальные группы) и семь – водой (контрольная группа). Жидкости наносили в течение 1, 2, 3 часов и в течение ночи (15 часов), смывали несколькими каплями воды и после проверяли твердость индентированием влажной эмали. При обработке Coca-Cola средняя твердость эмали составила 92,6% (SD = 7,9) от исходной исходной твердости через 1 час, 93,25% (SD = 10,15) через 2 часа, 85,7% (SD = 12,03) через 3 часа и 80,3 % через 15 часов. Средняя твердость при индентировании контрольных образцов, обработанных водой, составила 108,7% (SD = 16,09) от исходной твердости через 1 час, 99,09% (SD = 18,98) через 2 часа, 98,97% (SD = 11,24) через 3 часа и 98,42% (SD = 22,78) через 15 часов. В отдельном эксперименте твердость 9 образцов эмали тестировалась, как описано ранее, до и после обработки Coca-Cola в течение ночи и снова после нанесения искусственной слюны в течение 3 минут. Coca-Cola снизила среднюю твердость эмали на зубах при индентировании, но она была частично восстановлена искусственной слюной (Salivart) и увеличилась на 18% по сравнению с твердостью деминерализованной эмали.
Tantbirojn D. et al. (2008) измерениями твердости эмали по Кнупу in vitro установили (ANOVA, p<0,05), что нанесение пасты, содержащей аморфный фосфат кальция (CPP-ACP), с непрерывным пополнением слюнообразного раствора в течение 48 ч значительно отверждало эмаль, смягченную напитком Coca-Cola. Растворы, заменяющие слюну, представляли собой: слюноподобный раствор (SLS) с 1 ppm фторида, SLS без фтора и биотин для полоскания рта. При этом было выявлено, что биотин для полоскания рта смягчает эмалевую поверхность после 48 ч контакта.
Способность безалкогольного напитка или сока разрушать зубную эмаль зависит не только от рН напитка, но и от его буферного эффекта [19]. Поскольку последний является способностью напитка противостоять изменению рН, он может влиять на действие фактического рН. Целью исследования было сравнение pH и буферных свойств различных безалкогольных напитков с их эрозионным эффектом. В 18 безалкогольных напитках, минеральных водах и соках, доступных на датском рынке, были определены pH и концентрации кальция, фосфата и фтора. Буферный эффект определяли титрованием NaOH. Человеческие зубы (n = 54), покрытые лаком для ногтей, за исключением окон размером 3х4 мм, подвергались воздействию 1,5 литров напитка в течение 7 дней или 24 часов при постоянном перемешивании. Глубина эрозии оценивалась в продольных разрезах. Было установлено, что глубина сильно варьируется от 3 мм, вымываемых наиболее кислыми напитками и свежим апельсиновым соком, до незначительно пораженных поверхностей большинством минеральных вод. Растворение эмали увеличивалось логарифмически обратно пропорционально рН. Апельсиновый сок, рН 4,0, с добавлением 40 ммоль/л кальция и 30 ммоль/л фосфата не разрушал эмаль, поскольку кальций и фосфат насыщали напиток по отношению к апатиту. Как правило, чем ниже pH, тем больше NaOH необходимо для доведения pH до нейтрального. В частности, буферный эффект сока был высоким. Для всех напитков не наблюдалось влияния низких концентраций фтора.
Заслуживают внимания исследования, выполненные Chen X et al. в 2013 г. [11]. Авторы, используя отбеливающие зубы вещества в пробирке и кислые напитки, провели сравнительное исследование изменений морфологии поверхности эмали, содержания Ca/P и величины твердости. Отбеливающие зубы материалы, колу и апельсиновый сок использовали для замачивания зубов в искусственной слюне in vitro. Физиологический солевой раствор использовали в качестве контрольного лечения. Морфологию четырех групп наблюдали под сканирующим электронным микроскопом (SEM) сразу после того, как зубы были пропитаны в течение 7 и 14 дней. Были проанализированы изменения содержания Ca/P и микротвердости. Эмалевые поверхности зубов в трех испытательных группах были деминерализованы. Соотношение Ca/P и средняя микротвердость были значительно ниже, чем у контрольной группы сразу после замачивания зубов (p<0,05). Соотношение Ca/P и микротвердость постепенно увеличивались через 7 дней. Не наблюдалось значительного различия между контрольной группой и испытуемыми группами через 14 дней (р>0,05).В результате были сделаны следующие выводы. Отбеливающие агенты вызывали временную деминерализацию человеческой эмали, но эти агенты могли вызывать реминерализацию и восстановление эмали с течением времени. Деминерализация, вызванная отбеливанием, охватывает относительно нормальный диапазон по сравнению с кислыми напитками и ежедневным употреблением алкоголя.
Худанов Б.О. с соавт. [7] определили частоту потребления безалкогольных напитков у школьников и оценили эрозивный потенциал безалкогольных напитков гравиметрическим методом. Исследуемые напитки имели pH от 2,50 до 4,56. Наибольшая потеря массы была выявлена у образцов, хранившихся в напитках со значением pH < 3,5 (р<0,01). Риск развития эрозии зубов повышался вследствие привычки детей пить не через трубочку (70,0%) и удерживать напитки во рту (27,1%). Установлено, что высокая частота и способы употребления безалкогольных напитков повышают риск развития эрозии твердых тканей зубов у школьников.
В связи с тем, что главным и наиболее изученным фактором, оказывающим влияние на пораженность зубов кариесом, является фтор, особенно его содержание в воде, целью ряда исследований было изучение микротвердости эмали и дентина зубов у лиц, проживающих в различных климатогеографических зонах, определение взаимосвязи микротвердости с содержанием фтора в источниках питьевой воды и пораженностью населения кариесом. Исследованию в [3] были подвергнуты зубы с интактной эмалью. удаленные по ортопе- дическим и ортодонтическим показаниям у лиц 35-44 лет из различных климатогеографических зон Азербайджана: Зыря (низменный район, очаг эндемического флюороза, где концентрация фтора в источниках питьевой воды составляет 1,8 мг/л), Шеки (предгорье, очаг эндемического зоба; концентрация фтора 0,05 мг/л), Кедабека (горный район; концентрация фтора 0,32 мг/л) и Кюрдамира (низменный район; концентрация фтора 0,2-0,41 мг/л). При этом авторы отмечали, что в литературе не обнаружили данных о микротвердости эмали и дентина зубов у лиц, проживающих в различных климато-географических зонах.
Наиболее высокие показатели микротвердости эмали и дентина отмечены в Зыря, где концентрация фтора в источниках питьевой воды самая высокая. При этом наибольшие показатели микротвердости отмечены в поверхностных слоях эмали (391,8±5,7–432,9±6,3 кг/мм2). По мере приближения к эмалево-дентинному соединению показатели микротвердости уменьшаются. Так, в средних слоях эмали она составила 367,6±6,1–417,8±5,9 кг/мм2, у эмалево-дентинного соединения – 348,2±6,5–376,4±3,7 кг/мм2 (р<0,001). Из всех обследуемых регионов наиболее низкие показатели микротвердости эмали и дентина отмечены в Шеки с наименьшей концентрацией фтора в питьевой воде и в очаге эндемического зоба.
В результате проведенных исследований установлена прямая зависимость между концентрацией фтора и ряда других микроэлементов (меди, цинка, кобальта и др.) в источниках питьевой воды и микротвердостью эмали и дентина. Также выявлено благотворное влияние на микротвердость эмали и дентина ряда климатогеографических факторов, характерных для горной местности. Определена обратная зависимость между показателями интенсивности кариеса и микротвердости. Полученные данные могут служить показателем функциональной устойчивости твердых тканей зубов.
Действие некоторых кислых продуктов (лимон, яблоко, ацидин-пепсин) изучал С.М. Ремизов [5]. Ацидин- пепсин назначается при заболеваниях, которые сопровождаются снижением уровня соляной кислоты в желудке. Лабораторно установлены границы изменений в эмали в зависимости от продукта и продолжительности его воздействия. Установлено, что сок лимона, кислого яблока и раствор ацидин-пепсина вызывают понижение величины микротвердости эмали здоровых зубов человека. Наибольшее действие оказывает лимон, наименьшее – яблоко. Действие этих продуктов питания, а также раствора ацидин-пепсина, на эмаль в течение 3-х минут сопровождается понижением величины микротвердости по сравнению с интактной эмалью на 40, 21,5 и 26,5% соответственно. Данные статистически достоверны. Увеличение времени действия этих веществ на эмаль приводит к дальнейшему понижению ее микротвердости: через 20 минут твердость была зафиксированной ниже контрольной на 67, 39 и 49%, соответственно. Описанные изменения усугубляются последующим действием зубной щетки. Размягченный меловидноизмененный слой эмали (толщина 2-5 мкм) исчезает через 5-10 минут чистки с пастой “Жемчуг” (в настоящее время отечественной промышленностью выпускаются зубные пасты “Новый жемчуг”, АО Невская косметика и “Жемчуг московский”, АО Свобода).
Помимо влияния напитков и питьевой воды исследовали сравнительное действие на зубную эмаль средств гигиены. С.М. Ремизов и Л.Ю. Пружанский [6] изучали шероховатость эмали на предмет абразивности гигиенических средств при трении зубной щеткой с тем или иным средством (абразивность – способность истирать какую-либо поверхность). Исследовали 15 гигиенических средств (13 отечественных и 2 импортных), щетка прижималась к образцу зуба с усилием 300 гс. Определяли среднее арифметическое отклонения профиля поверхности от его средней линии, известное как Ra. Испытанные гигиенические средства располагаются в порядке возрастающей способности следующим образом: пасты “Жемчуг”, “Чебурашка”, “Семейная”, “Мятная”, “Лесная”, “БАМ”, “Ягодка”, зубные порошки “Детский”, “Жемчуг”, “Мятный”, “Особый”, пасты “Апельсиновая”, “Олимп”, “Поморин”, “Колинос”. Паста “Колинос” абразивнее других гигиенических средств в 3-6 раз. Шероховатость эмали за период испытаний 270 мин с разными средствами возрастала в 5-10 раз, а при использовании пасты Колинос – в 32 раза по сравнению с исходной.
Целью исследования [24] было оценить влияние фторидных, ксилитных, пробиотических и отбеливающих зубных паст на шероховатость и микротвердость эмали постоянных зубов. Сто двадцать зубов были случайным образом разделены на 2 группы, каждая из которых имела 60 образцов. G1: группа, в которой исследовалась шероховатость эмали (n = 60). G2: группа, в которой исследовалась микротвердость эмали (n = 60). Затем эти группы были случайным образом разделены на 4 группы между собой (n=15). Каждую группу чистили с использованием четырех разных зубных паст в течение 1 недели с помощью зубной щетки с батарейным питанием утром и вечером в течение 2 минут. Твердомер Виккерса использовался для измерения изменений микротвердости, а профилометр – для измерения изменений шероховатости поверхности. Статистически значимых различий не было обнаружено по значениям шероховатости поверхности и микротвердости, измеренным после процесса чистки зубов в группе, в которой использовалась зубная паста Colgate MaxFresh (p>0,01). Статистически значимое снижение твердости по Виккерсу наблюдалось в группах, в которых использовали для чистки зубов пасты Ipana White Power Carbonate, Periobiotic Probiotic и гель Xyliwhite Toothpaste (p<0,01). Статистически значимое увеличение наблюдалось по значениям шероховатости поверхности в группах, где зубы обрабатывались зубной пастой Ipana White Power Carbonate, гелем с зубной пастой Xyliwhite, пробиотической зубной пастой с периобиотическими пробиотиками (p<0,01). По результатам исследований были сделаны следующие выводы: зубная паста Colgate MaxFresh без абразива с фтором не влияет на шероховатость поверхности зубной эмали и ее микротвердость. Абразивные зубные пасты Xyliwhite, Periobiotic и Ipana White Power, содержащие карбонат, приводили к отрицательным изменениям шероховатости поверхности эмали постоянных зубов и микротвердости.
Другими исследователями микротвердость по Кнупу и шероховатость поверхности (Ra) различных реставрационных материалов анализировали в заранее определенные периоды оценки: 24 часа, 7, 30 и 60 дней после изготовления образцов. Было установлено, что микротвердость композитных материалов оставалась стабильной по величине до 1 месяца выдержки в напитках (Coca-Cola, на основе сахарного тростника, кофе и искусственная слюна – контроль), но значительно снижалась на второй месяц (Badra VV et al., 2005 [8]). Шероховатость образцов при этом почти синхронно увеличивалась.
Выводы.
Газированные и фруктовые напитки снижают механические свойства эмали, шероховатость эмали при этом, наоборот, возрастает. Потребление газированных напитков является одним из этиологических факторов, вызывающих эрозию зубов.
Усилия по защите зубов от эрозивных веществ включают в себя снижение потребления кислой пищи, цитрусовых и газированных напитков (в особенности Coca-Cola), а также добавление в них лактата кальция. После питья соков, особенно кислых, рекомендуется полоскать рот. Кроме того, кислые фруктовые соки следует пить через соломинку, чтобы уберечь зубную эмаль от повреждения.
Средняя твердость эмали зубов при индентировании, сниженная обработкой Coca-Cola, частично восстанавливается искусственной слюной (Salivart).
Нанесение пасты, содержащей аморфный фосфат кальция (CPP-ACP), с непрерывным пополнением слюнообразного раствора в течение 48 ч значительно отверждает эмаль, смягченную напитком Coca-Cola.
Установлена прямая зависимость между концентрацией фтора и ряда других микроэлементов (меди, цинка, кобальта и др.) в источниках питьевой воды и микротвердостью эмали и дентина. Показатели микротвердости эмали и дентина зубов у лиц, проживающих в различных климатогеографических зонах, отличаются друг от друга и максимальны в районах, где концентрация фтора в источниках питьевой воды наиболее высокая и, наоборот, минимальны в регионах с наименьшей концентрацией фтора в питьевой воде.
Работа выполнена в соответствии с планами НИР кафедр пропедевтики стоматологических заболеваний, нормальной физиологии и медицинской физики МГМСУ им. А.И. Евдокимова.
Список литературы / References:
1. Лебеденко И.Ю., Арутюнов С.Д., Муслов С.А., Усеинов А.С. Нанотвердость и модуль Юнга зубной эмали. Вестник РУДН, серия Медицина, 2009, № 4, с. 637-638. [Lebedenko I.Yг., Arutyunov S.D., Muslov S.A., Useinov A.S. Nanotverdost' i modul' YUnga zubnoj emali. Vestnik RUDN, seriya Medicina, 2009, no. 4, pp. 637-638. (In Russ.)]
2. Лебеденко И.Ю., Арутюнов С.Д., Муслов С.А., Усеинов А.С. Исследование наномеханических свойств зубной эмали. Кафедра, зима 2009-2010, № 32, с. 24-28. [Lebedenko I.Yu., Arutyunov S.D., Muslov S.A., Useinov
A.S. Issledovanie nanomekhanicheskih svojstv zubnoj emali. Kafedra, zima 2009-2010, no. 32, pp. 24-28. (In Russ.)]
3. Пашаев Ч.А., Ахмедов P.M., Халифа-заде Ч.М. Влияние фтора и других биогеохимических факторов на микротвердость эмали и дентина. Стоматология, 1990, № 6, с. 10-12. [Pashaev Ch.A., Ahmedov P.M., Halifa-zade Ch.M. Vliyanie ftora i drugih biogeohimicheskih faktorov na mikrotverdost' emali i dentina. Stomatologiya, 1990, no. 6, pp. 10-12. (In Russ.)]
4. Перцов С.С., Стюрева Г.М., Муслов С.А., Синицын А.А., Корнеев А.А., Зайцева Н.В. Основы биомеханики для стоматологов. МГМСУ, 2017, 115 с. [Percov S.S., Styureva G.M., Muslov S.A., Sinicyn A.A., Korneev A.A., Zajceva N.V. Osnovy biomekhaniki dlya stomatologov. MGMSU, 2017, 115 p. (In Russ.)]
5. Ремизов С.М. Влияние на эмаль зубов человека кислых продуктов. Основные стоматологические заболевания, 1981, с. 67-69. [Remizov S.M. Vliyanie na emal' zubov cheloveka kislyh produktov. Osnovnye stomatologicheskie zabolevaniya, 1981, pp. 67-69. (In Russ.)]
6. Ремизов С.М., Пружанский Л.Ю. Оценка абразивности средств гигиены полости рта по изменению шероховатости эмали зуба. Стоматология, 1983, т. 3, с. 20-23. [Remizov S.M., Pruzhanskij L.Yu. Ocenka abrazivnosti sredstv gigieny polosti rta po izmeneniyu sherohovatosti emali zuba. Stomatologiya, 1983, vol. 3, pp. 20-23. (In Russ.)]
7. Худанов Б.О., Маслак Е.Е., Халилов И.Х., Тураев К.И., Абдурахимова Ф.А. Потребление школьниками безалкогольных напитков и их эрозивный потенциал (по данным гравиметрии in vitro). Стоматология детского возраста и профилактика, 2019, т. 19 (2), с. 25-29. DOI: 10.33925/1683-3031-2019-19-2-25-29. [Hudanov B.O., Maslak E.E., Halilov I.H., Turaev K.I., Abdurahimova F.A. Potreblenie shkol'nikami bezalkogol'nyh napitkov i ih erozivnyj potencial (po dannym gravimetrii in vitro). Stomatologiya detskogo vozrasta i profilaktika, 2019, vol. 19 (2), pp. 25-29. (In Russ.)]
8. Badra V.V., Faraoni J.J., Ramos R.P., Palma-Dibb R.G. Influence of different beverages on the microhardness and surface roughness of resin composites. Oper Dent, 2005, vol. 30, pp. 213-219.
9. Barbour M.E., Finke M., Parker D.M., Hughes J.A., Allen G.C., Addy M. The relationship between softening and erosion caused by soft drinks at a range of temperatures. J Dent, 2006, vol. 34, pp. 207-213.
10. Beiraghi S., Atkins S., Rosen S., Wilson S., Odom J., Beck M. Effect of calcium lactate in erosion and S. mutans in rats when added to Coca-Cola. Pediatr Dent, 1989, vol. 11, pp. 312-315.
11. Chen X., Chen Z., Lin Y., Shao J., Yin L. Effects of tooth whitening agents and acidic drinks on the surface properties of dental enamel. Hua Xi Kou Qiang Yi Xue Za Zhi, 2013, vol. 31(5), pp. 530-532.
12. Devlin H., Bassiouny M., Boston D. Hardness of enamel exposed to Coca-Cola® and artificial saliva. Journal of Oral Rehabilitation, 2006, vol. 33, no. 1, pp. 26-30.
13. Dodds M., Peggy P., Rodriguez D. The effect of some Mexican citric acid snacks on vitro tooth enamel erosion.
Pediatr. Dent., 1997, vol. 19, pp. 339-340.
14. Edwards M., Creanor S.L., Foye R.H., Gilmour W.H. Buffering capacities of soft drinks: the potential influence on dental erosion. J. Oral Rehabil., 1999, vol. 26, pp. 923-927.
15. Eisenburger M., Addy M. Influence of liquid temperature and flow rate on enamel erosion and surface softening.
J. Oral Rehabil., 2003, vol. 30, pp. 1076-1080.
16. Fallahinejad Ghajari M., Nabavi Razavi S. Comparing the effect of Iranian soft drinks with the standard sample; Calcium ion analysis. J. Tehran. Univ. Med. Sci., 2007, vol. 20, pp. 27-32.
17. Ganss C., Lussi A., Klimek J. Comparison of calcium/ phosphorus analysis, longitudinal micro radiography and profilometry for the quantitative assessment of erosive de‑mineralization. Caries Res., 2005, vol. 39, pp. 178-184.
18. Haghgou H.R., Haghgoo R., Asdollah F.M. Comparison of the microhardness of primary and permanent teeth after immersion in two types of carbonated beverages. J. Int. Soc. Prevent Communit Dent. [serial online], 2016, vol. 6, pp. 344-8.
19. Larsen M.J., Nyvad B. Enamel erosion by some soft drinks and orange juices relative to their pH, buffering effect and contents of calcium phosphate. Caries Res., 1999, vol. 33 (1), pp. 81-87.
20. Lippert F., Parker D.M., Jandt K.D. Susceptibility of deciduous and permanent enamel to dietary acid induced erosion studied with atomic force microscopy nano indentation. Eur. J. Oral Sci., 2004, vol. 112, pp. 61-66.
21. Lussi A., Jaeggi T., Jaeggi-Scharer S. Prediction of the erosive potential of some beverages. Caries Res, 1995, vol. 29, pp. 349-354.
22. Lussi A., Kohler N., Zero D., Schaffner M., Megert B. A comparison of the erosive potential of different beverages in primary and permanent teeth using an in vitro model. Eur. J. Oral Sci., 2000, vol. 108 (2), pp. 110-114.
23. Machado C. et al. Human Enamel Nanohardness, Elastic Modulus and Surface Integrity after Beverage Contact.
Braz Dent J, 2008, vol. 19 (1), pp. 68-72.
24. Maden E.A., Altun C., Polat G.G., Basak F. The In vitro Evaluation of the effect of xyliwhite, probiotic, and the conventional toothpastes on the enamel roughness and microhardness. Niger J. Clin. Pract. [serial online], 2018, vol. 21, pp. 306-311.
25. Maupome G., Diez de Bonilla J., Torres-Villasenor G., Andrade-Delgado L.C., Castaño V.M. In vitro quantitative assessment of enamel microhardness after exposure to eroding immersion in cola drink. Caries Res., 1998, vol. 32, pp. 148-153.
26. Meurman J.H., Frank R.M. Progression and surface ultrastructure of in vitro caused erosive lesions in human and bovine enamel. Caries Res., 1991, vol. 25, pp. 81-87.
27. Schlueter N., Hara A., Shellis R.P., Ganss C. Methods for the measurement and characterization of erosion in enamel and dentine. Caries Res., 2011, vol. 45, suppl. 1, pp. 13-23.
28. Tantbirojn D., Huang A., Ericson M., Poolthong S. Change in surface hardness of enamel by a cola drink and a CPP–ACP paste. Journal of Dentistry, 2008, vol. 36, no. 1, pp. 74-79.
29. West N.X., Hughes J.A., Addy M. Erosion of dentine and enamel in vitro by dietary acids: the effect of temperature, acid character, concentration and exposure time. J. Oral Rehabil., 2000, vol. 27, pp. 875-880.
30. West N.X., Hughes J.A., Addy M. The effect of pH on the erosion of dentine and enamel by dietary acids in vitro. J Oral Rehabil, 2001, vol. 28, pp. 860-864.
31. Zero D.T. Etiology of dental erosion - extrinsic factors. Eur. J. Oral Sci., 1996, vol. 104, pp. 162-177.
INFLUENCE OF MILK AND DAIRY PRODUCTS ON THE HARDNESS AND ROUGHNESS OF TEETH ENAMEL
Muslov S.A.1, Babaitseva L.A.2, Khasanov F.K.1
1 A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Moscow, Russia; e-mail: muslov@mail.ru
2 Dental Clinic No. 61 of the Moscow Department of Health
Moscow, Russia
Abstract. Over the past 10 years, sales of fruit juices and carbonated drinks have grown by 55% and are estimated to grow by about 2-3% per year. A number of acidic fruit juices and drinks, which are part of the daily diet, are the causes of the destruction of the tooth structure and a decrease in the elasticity and hardness of their surface. In this paper, a review of published data on the influence of the environment of the oral cavity and drinks on the basic mechanical properties of tooth enamel (elastic modulus, hardness and roughness) is performed.
Key words: products, drinks, mechanical properties, Young's modulus, hardness, roughness, erosion, tooth enamel.




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
