Профилактика патологии слизистой оболочки рта у пациентов со съемными зубными протезами
Л. Р. Сарап, заведующая кафедрой стоматологии детского возраста АГМУ, к.м.н.
Л. Ю. Бутакова, заведующая кафедрой микробиологии и вирусологии АГМУ, к.м.н.
Ю. А. Зенкова, ассистент кафедры ортопедической стоматологии АГМУ, к.м.н.
С. К. Матело, генеральный директор группы компаний «Диарси»
Т. В. Купец, руководитель научно-информационного отдела группы компаний «Диарси»
Л. Ю. Бутакова, заведующая кафедрой микробиологии и вирусологии АГМУ, к.м.н.
Ю. А. Зенкова, ассистент кафедры ортопедической стоматологии АГМУ, к.м.н.
С. К. Матело, генеральный директор группы компаний «Диарси»
Т. В. Купец, руководитель научно-информационного отдела группы компаний «Диарси»
Подробнее
Нет в наличии
Описание
Одной из распространенных проблем протезирования частичными или полными съемными конструкциями является возникновение воспаления слизистой оболочки протезного ложа. При пользовании пластиночными протезами нередко развивается воспалительный инфекционный процесс, так как зубные протезы и слизистая оболочка протезного ложа обсеменены патогенной микробной флорой [1]. Ношение протезов приводит к развитию стоматита в 65% случаев [2]. Количество микроорганизмов на одном протезе составляет 1×10 6 —2×10 9 микробных клеток [3]. Известно, что некоторые группы бактерий, населяющих данную экологическую нишу, могут обладать факторами вирулентности и способностью вызывать воспалительный процесс слизистой оболочки полости рта и тканей пародонта [4]. Так, микроскопическое исследование соскобов с внутренней поверхности базисов съемных протезов и мазков со слизистой оболочки протезного ложа показало, что у больных с гиперемированной слизистой протезного ложа почти в 90% случаев на внутренней поверхности протеза и 60% на слизистой оболочки обнаруживаются элементы грибов [1].
При длительном пользовании съемными протезами микроорганизмы могут проникать в толщу пластмассы на глубину 2—2,5 мм. Микрофлора, присутствующая на протезе, — как живая, так и погибшая, — воздействует не только местно, но и в целом на макроорганизм. Местное воздействие обусловлено выделением бактериальных токсинов, которые способствуют развитию воспалительного процесса слизистой оболочки или поддерживают уже имеющийся. С другой стороны, постоянное присутствие микроорганизмов на протезах может вызвать состояние сенсибилизации и изменение иммунологической реактивности организма [3].
Среди микроорганизмов, частостановящихся причиной протез-ных стоматитов наибольшая рольотводится грибам рода Candida [5].
В большой степени риск кандидоза связан с режимом эксплуатации протезов, а также отсутствием качественного ухода за ними. Известно, что акриловые стоматиты наиболее часто возникают у пациентов, не снимающих зубные протезы на ночь или хранящих их сухими в ночное время [6]. У лиц, не снимающих зубные протезы на ночь, количество Candida albicans в 10 раз больше, чем у пациентов, пользующихся съемными протезами только в дневное время [1]. J. Kraft и соавт. [7] в исследованиях in vitro доказали, что при пользовании средствами, улучшающими адгезию съемных протезов со слизистой оболочкой, происходит увеличение количества колоний рода Candida. У таких пациентов резко возрастает риск кандидозных стоматитов. Лечение кандидозных стоматитов с помощью назначаемых системно противогрибковых препаратов обеспечивает излечение от 53 до 89% в зависимости от примененного препарата, однако клинические данные свидетельствуют о быстром развитии резистентности даже к самым новым и высокоэффективным фунгицидам [8]. Одним из серьезных ограничений для использования в терапии оральных кандидозов системно применяемых фунгицидных препаратов является большое число побочных эффектов (от гепатотоксичности до высокой аллергенности) [2]. Кроме того, обращает на себя внимание тот факт, что в плацебо-контролируемых исследованиях в группе плацебо выявляется значительный процент излечившихся пациентов, что исследователи связывают с изменением режима гигиены съемных зубных протезов [2].
Воспаление в области протезного ложа может быть связано и с другими патогенными микроорганизмами полости рта (гемолитический стрептококк, золотистый стафилококк и др.).
Микробиологическими, биохимическими и структурными исследованиями налета на съемных зубных протезах показали, что он подобен налету на поверхности натуральных зубов [1]. Простая дезинфекция протезов не может обеспечить их безопасность, так как дезинфицирующие средства вызывают только гибель бактерий, оставляя на базисе протеза большое количество зубных отложений, на которых с еще большей интенсивностью в дальнейшем фиксируются микроорганизмы. В настоящее время среди очищающих средств для съемных протезов далеко не все обладают хорошим деадгезивным действием, поэтому большинство авторов приходят к выводу о необходимости механической очистки протезов [4].
Сегодня имеются убедительные данные о деконтаминирующем действии протеолитических ферментов, по эффективности сопоставимой с соответствующим действием химических антисептиков [9]. Деадгезивное действие различных ферментных препаратов при обработке протезов подтверждено клиническими испытаниями [3]. Некоторые современные составы обладают не только способностью к ферментативной деконтаминации, но и подавляют специфическую адгезию ряда патогенов, в частности, действие зубной пасты R.O.C.S., содержащей бромелаин, затрагивает один из механизмов адгезии Candida albicans [10].
Исходя из этого, можно предположить, что уровень обсемененности съемных зубных протезов патогенными микроорганизмами может быть понижен за счет применения ферментсодержащей зубной пасты, что в свою очередь может приводить к улучшению состояния слизистой полости рта. Учитывая, что зубные пасты, включающие протеолитические ферменты и не имеющие ограничений по применению, а в доступной литературе отсутствуют сведения о влиянии таких составов на микрофлору полости рта, и было предпринято настоящее исследование.
Цель исследования
Доля высеивавшихся грибов рода Candida albicans снизилась с 15 до 3,5%. Уменьшение количества Candida albicans составило 76,7% от исходного числа.
Благоприятные изменения в составе микробной флоры коррелировали с улучшением состояния слизистой оболочки протезного ложа. Редукция воспаления слизистой оболочки наблюдалась у 93% пациентов (из 14 пациентов с отечной и гиперемированной слизистой в 13 случаев слизистая оболочка стала бледно-розовой, безболезненной).
Основой профилактики и лечения инфекций слизистой оболочки протезного ложа является правильная гигиена полости рта и надлежащий уход за съемными протезными конструкциями.
Полученные в ходе исследования результаты позволяют сформулировать следующие выводы:
При длительном пользовании съемными протезами микроорганизмы могут проникать в толщу пластмассы на глубину 2—2,5 мм. Микрофлора, присутствующая на протезе, — как живая, так и погибшая, — воздействует не только местно, но и в целом на макроорганизм. Местное воздействие обусловлено выделением бактериальных токсинов, которые способствуют развитию воспалительного процесса слизистой оболочки или поддерживают уже имеющийся. С другой стороны, постоянное присутствие микроорганизмов на протезах может вызвать состояние сенсибилизации и изменение иммунологической реактивности организма [3].
Среди микроорганизмов, частостановящихся причиной протез-ных стоматитов наибольшая рольотводится грибам рода Candida [5].
В большой степени риск кандидоза связан с режимом эксплуатации протезов, а также отсутствием качественного ухода за ними. Известно, что акриловые стоматиты наиболее часто возникают у пациентов, не снимающих зубные протезы на ночь или хранящих их сухими в ночное время [6]. У лиц, не снимающих зубные протезы на ночь, количество Candida albicans в 10 раз больше, чем у пациентов, пользующихся съемными протезами только в дневное время [1]. J. Kraft и соавт. [7] в исследованиях in vitro доказали, что при пользовании средствами, улучшающими адгезию съемных протезов со слизистой оболочкой, происходит увеличение количества колоний рода Candida. У таких пациентов резко возрастает риск кандидозных стоматитов. Лечение кандидозных стоматитов с помощью назначаемых системно противогрибковых препаратов обеспечивает излечение от 53 до 89% в зависимости от примененного препарата, однако клинические данные свидетельствуют о быстром развитии резистентности даже к самым новым и высокоэффективным фунгицидам [8]. Одним из серьезных ограничений для использования в терапии оральных кандидозов системно применяемых фунгицидных препаратов является большое число побочных эффектов (от гепатотоксичности до высокой аллергенности) [2]. Кроме того, обращает на себя внимание тот факт, что в плацебо-контролируемых исследованиях в группе плацебо выявляется значительный процент излечившихся пациентов, что исследователи связывают с изменением режима гигиены съемных зубных протезов [2].
Воспаление в области протезного ложа может быть связано и с другими патогенными микроорганизмами полости рта (гемолитический стрептококк, золотистый стафилококк и др.).
Микробиологическими, биохимическими и структурными исследованиями налета на съемных зубных протезах показали, что он подобен налету на поверхности натуральных зубов [1]. Простая дезинфекция протезов не может обеспечить их безопасность, так как дезинфицирующие средства вызывают только гибель бактерий, оставляя на базисе протеза большое количество зубных отложений, на которых с еще большей интенсивностью в дальнейшем фиксируются микроорганизмы. В настоящее время среди очищающих средств для съемных протезов далеко не все обладают хорошим деадгезивным действием, поэтому большинство авторов приходят к выводу о необходимости механической очистки протезов [4].
Сегодня имеются убедительные данные о деконтаминирующем действии протеолитических ферментов, по эффективности сопоставимой с соответствующим действием химических антисептиков [9]. Деадгезивное действие различных ферментных препаратов при обработке протезов подтверждено клиническими испытаниями [3]. Некоторые современные составы обладают не только способностью к ферментативной деконтаминации, но и подавляют специфическую адгезию ряда патогенов, в частности, действие зубной пасты R.O.C.S., содержащей бромелаин, затрагивает один из механизмов адгезии Candida albicans [10].
Исходя из этого, можно предположить, что уровень обсемененности съемных зубных протезов патогенными микроорганизмами может быть понижен за счет применения ферментсодержащей зубной пасты, что в свою очередь может приводить к улучшению состояния слизистой полости рта. Учитывая, что зубные пасты, включающие протеолитические ферменты и не имеющие ограничений по применению, а в доступной литературе отсутствуют сведения о влиянии таких составов на микрофлору полости рта, и было предпринято настоящее исследование.
Цель исследования
Оценить влияние зубной пасты R.O.C.S. на слизистую оболочку протезного ложа у пациентов, пользующихся съемными ортопедическими конструкциями с учетом состава микрофлоры полости рта.
Задачи исследования:
- Определить влияние зубной пасты R.O.C.S. на состав микрофлоры слизистой оболочки полости рта.
- Оценить изменение состояния слизистой оболочки полости рта и протезного ложа с помощью пробы Шиллера — Писарева до применения зубной пасты R.O.C.S. и через 2 нед ее применения.
Одной из распространенных проблем протезирования частичными или полными съемными конструкциями является возникновение воспаления слизистой оболочки протезного ложа. При пользовании пластиночными протезами нередко развивается воспалительный инфекционный процесс, так как зубные протезы и слизистая оболочка протезного ложа обсеменены патогенной микробной флорой [1]. Ношение протезов приводит к развитию стоматита в 65% случаев [2]. Количество микроорганизмов на одном протезе составляет 1×10 6 —2×10 9 микробных клеток [3]. Известно, что некоторые группы бактерий, населяющих данную экологическую нишу, могут обладать факторами вирулентности и способностью вызывать воспалительный процесс слизистой оболочки полости рта и тканей пародонта [4]. Так, микроскопическое исследование соскобов с внутренней поверхности базисов съемных протезов и мазков со слизистой оболочки протезного ложа показало, что у больных с гиперемированной слизистой протезного ложа почти в 90% случаев на внутренней поверхности протеза и 60% на слизистой оболочки обнаруживаются элементы грибов [1].
При длительном пользовании съемными протезами микроорганизмы могут проникать в толщу пластмассы на глубину 2—2,5 мм. Микрофлора, присутствующая на протезе, — как живая, так и погибшая, — воздействует не только местно, но и в целом на макроорганизм. Местное воздействие обусловлено выделением бактериальных токсинов, которые способствуют развитию воспалительного процесса слизистой оболочки или поддерживают уже имеющийся. С другой стороны, постоянное присутствие микроорганизмов на протезах может вызвать состояние сенсибилизации и изменение иммунологической реактивности организма [3].
Среди микроорганизмов, частостановящихся причиной протез-ных стоматитов наибольшая рольотводится грибам рода Candida [5].
В большой степени риск кандидоза связан с режимом эксплуатации протезов, а также отсутствием качественного ухода за ними. Известно, что акриловые стоматиты наиболее часто возникают у пациентов, не снимающих зубные протезы на ночь или хранящих их сухими в ночное время [6]. У лиц, не снимающих зубные протезы на ночь, количество Candida albicans в 10 раз больше, чем у пациентов, пользующихся съемными протезами только в дневное время [1]. J. Kraft и соавт. [7] в исследованиях in vitro доказали, что при пользовании средствами, улучшающими адгезию съемных протезов со слизистой оболочкой, происходит увеличение количества колоний рода Candida. У таких пациентов резко возрастает риск кандидозных стоматитов. Лечение кандидозных стоматитов с помощью назначаемых системно противогрибковых препаратов обеспечивает излечение от 53 до 89% в зависимости от примененного препарата, однако клинические данные свидетельствуют о быстром развитии резистентности даже к самым новым и высокоэффективным фунгицидам [8]. Одним из серьезных ограничений для использования в терапии оральных кандидозов системно применяемых фунгицидных препаратов является большое число побочных эффектов (от гепатотоксичности до высокой аллергенности) [2]. Кроме того, обращает на себя внимание тот факт, что в плацебо-контролируемых исследованиях в группе плацебо выявляется значительный процент излечившихся пациентов, что исследователи связывают с изменением режима гигиены съемных зубных протезов [2].
Воспаление в области протезного ложа может быть связано и с другими патогенными микроорганизмами полости рта (гемолитический стрептококк, золотистый стафилококк и др.).
Микробиологическими, биохимическими и структурными исследованиями налета на съемных зубных протезах показали, что он подобен налету на поверхности натуральных зубов [1]. Простая дезинфекция протезов не может обеспечить их безопасность, так как дезинфицирующие средства вызывают только гибель бактерий, оставляя на базисе протеза большое количество зубных отложений, на которых с еще большей интенсивностью в дальнейшем фиксируются микроорганизмы. В настоящее время среди очищающих средств для съемных протезов далеко не все обладают хорошим деадгезивным действием, поэтому большинство авторов приходят к выводу о необходимости механической очистки протезов [4].
Сегодня имеются убедительные данные о деконтаминирующем действии протеолитических ферментов, по эффективности сопоставимой с соответствующим действием химических антисептиков [9]. Деадгезивное действие различных ферментных препаратов при обработке протезов подтверждено клиническими испытаниями [3]. Некоторые современные составы обладают не только способностью к ферментативной деконтаминации, но и подавляют специфическую адгезию ряда патогенов, в частности, действие зубной пасты R.O.C.S., содержащей бромелаин, затрагивает один из механизмов адгезии Candida albicans [10].
Исходя из этого, можно предположить, что уровень обсемененности съемных зубных протезов патогенными микроорганизмами может быть понижен за счет применения ферментсодержащей зубной пасты, что в свою очередь может приводить к улучшению состояния слизистой полости рта. Учитывая, что зубные пасты, включающие протеолитические ферменты и не имеющие ограничений по применению, а в доступной литературе отсутствуют сведения о влиянии таких составов на микрофлору полости рта, и было предпринято настоящее исследование.
Цель исследования
Оценить влияние зубной пасты R.O.C.S. на слизистую оболочку протезного ложа у пациентов, пользующихся съемными ортопедическими конструкциями с учетом состава микрофлоры полости рта.
В соответствии с задачами исследования было обследовано 30 пациентов в возрасте старше 40 лет, пользующихся съемными ортопедическими конструкциями (частичные и полные съемные пластиночные протезы). Пациентам было рекомендовано чистить зубы и съемные акриловые конструкции 2 раза в день зубной пастой R.O.C.S, содержащей протеолитический фермент бромелаин, обладающий противоналетным и антиадгезивным действием [10]. Других изменений в режим ухода за съемными зубными протезами не вносилось.
На момент обследования все пациенты считали себя здоровыми, не имели тяжелых органических поражений дыхательных путей и желудочно-кишечного тракта. Все пациенты были ранжированы по возрасту и по времени забора материала (утром, до чистки зубов и съемных конструкций). Обследование пациентов проводилось по общепринятой методике, включающей сбор жалоб, анамнеза жизни, анамнеза заболевания, внешнего осмотра и локально полости рта с использованием стандартного набора стоматологических инструментов.
Состояние слизистой оболочки оценивалось при естественном освещении с учетом цвета, рельефа, влажности, тургора. Осмотр слизистой оболочки полости рта производился в направлении от преддверия полости рта к зеву, особое внимание уделялось участкам слизистой оболочки протезного ложа.
Клинический диагноз определялся при частичном отсутствии зубов по классификации Кеннеди, при полном отсутствии зубов на верхней челюсти — по классификации Шредера, на нижней челюсти — по классификации Келлера. Все данные подробно отражены в медицинской карте стоматологического больного (форма No 043/у). Далее проводилась проба Шиллера—Писарева.
Исследования микрофлоры слизистой оболочки протезного ложа
Первое бактериологическое исследование микрофлоры слизистой оболочки протезного ложа проводилось до использования зубной пасты R.O.C.S. Стандартным стерильным ватным тампоном материал снимался со слизистой протезного ложа, после чего его засевали на кровяной агар, сахарный бульон и среду Сабуро для выделения грибов, используя всю поверхность тампона [11]. Посевы инкубировали в термостате при 37°С в течение 24 часов (плотные питательные среды) или 2 сут (бульон). Микроорганизмы идентифицировали по общепринятой схеме. Материал подвергался подсчету колониеобразующих единиц (КОЕ) с идентификацией по бинарной номенклатуре до рода и вида.
Через 2 нед применения зубной пасты было проведено повторное исследование слизистой оболочки протезного ложа (микробиологи-ческое и индексы гигиены).
Результаты и обсуждение
Исследования микрофлоры слизистой оболочки протезного ложа у пациентов, пользующихся съемными зубными протезами, показали следующие результаты:
При длительном пользовании съемными протезами микроорганизмы могут проникать в толщу пластмассы на глубину 2—2,5 мм. Микрофлора, присутствующая на протезе, — как живая, так и погибшая, — воздействует не только местно, но и в целом на макроорганизм. Местное воздействие обусловлено выделением бактериальных токсинов, которые способствуют развитию воспалительного процесса слизистой оболочки или поддерживают уже имеющийся. С другой стороны, постоянное присутствие микроорганизмов на протезах может вызвать состояние сенсибилизации и изменение иммунологической реактивности организма [3].
Среди микроорганизмов, частостановящихся причиной протез-ных стоматитов наибольшая рольотводится грибам рода Candida [5].
В большой степени риск кандидоза связан с режимом эксплуатации протезов, а также отсутствием качественного ухода за ними. Известно, что акриловые стоматиты наиболее часто возникают у пациентов, не снимающих зубные протезы на ночь или хранящих их сухими в ночное время [6]. У лиц, не снимающих зубные протезы на ночь, количество Candida albicans в 10 раз больше, чем у пациентов, пользующихся съемными протезами только в дневное время [1]. J. Kraft и соавт. [7] в исследованиях in vitro доказали, что при пользовании средствами, улучшающими адгезию съемных протезов со слизистой оболочкой, происходит увеличение количества колоний рода Candida. У таких пациентов резко возрастает риск кандидозных стоматитов. Лечение кандидозных стоматитов с помощью назначаемых системно противогрибковых препаратов обеспечивает излечение от 53 до 89% в зависимости от примененного препарата, однако клинические данные свидетельствуют о быстром развитии резистентности даже к самым новым и высокоэффективным фунгицидам [8]. Одним из серьезных ограничений для использования в терапии оральных кандидозов системно применяемых фунгицидных препаратов является большое число побочных эффектов (от гепатотоксичности до высокой аллергенности) [2]. Кроме того, обращает на себя внимание тот факт, что в плацебо-контролируемых исследованиях в группе плацебо выявляется значительный процент излечившихся пациентов, что исследователи связывают с изменением режима гигиены съемных зубных протезов [2].
Воспаление в области протезного ложа может быть связано и с другими патогенными микроорганизмами полости рта (гемолитический стрептококк, золотистый стафилококк и др.).
Микробиологическими, биохимическими и структурными исследованиями налета на съемных зубных протезах показали, что он подобен налету на поверхности натуральных зубов [1]. Простая дезинфекция протезов не может обеспечить их безопасность, так как дезинфицирующие средства вызывают только гибель бактерий, оставляя на базисе протеза большое количество зубных отложений, на которых с еще большей интенсивностью в дальнейшем фиксируются микроорганизмы. В настоящее время среди очищающих средств для съемных протезов далеко не все обладают хорошим деадгезивным действием, поэтому большинство авторов приходят к выводу о необходимости механической очистки протезов [4].
Сегодня имеются убедительные данные о деконтаминирующем действии протеолитических ферментов, по эффективности сопоставимой с соответствующим действием химических антисептиков [9]. Деадгезивное действие различных ферментных препаратов при обработке протезов подтверждено клиническими испытаниями [3]. Некоторые современные составы обладают не только способностью к ферментативной деконтаминации, но и подавляют специфическую адгезию ряда патогенов, в частности, действие зубной пасты R.O.C.S., содержащей бромелаин, затрагивает один из механизмов адгезии Candida albicans [10].
Исходя из этого, можно предположить, что уровень обсемененности съемных зубных протезов патогенными микроорганизмами может быть понижен за счет применения ферментсодержащей зубной пасты, что в свою очередь может приводить к улучшению состояния слизистой полости рта. Учитывая, что зубные пасты, включающие протеолитические ферменты и не имеющие ограничений по применению, а в доступной литературе отсутствуют сведения о влиянии таких составов на микрофлору полости рта, и было предпринято настоящее исследование.
Цель исследования
Оценить влияние зубной пасты R.O.C.S. на слизистую оболочку протезного ложа у пациентов, пользующихся съемными ортопедическими конструкциями с учетом состава микрофлоры полости рта.
В соответствии с задачами исследования было обследовано 30 пациентов в возрасте старше 40 лет, пользующихся съемными ортопедическими конструкциями (частичные и полные съемные пластиночные протезы). Пациентам было рекомендовано чистить зубы и съемные акриловые конструкции 2 раза в день зубной пастой R.O.C.S, содержащей протеолитический фермент бромелаин, обладающий противоналетным и антиадгезивным действием [10]. Других изменений в режим ухода за съемными зубными протезами не вносилось.
На момент обследования все пациенты считали себя здоровыми, не имели тяжелых органических поражений дыхательных путей и желудочно-кишечного тракта. Все пациенты были ранжированы по возрасту и по времени забора материала (утром, до чистки зубов и съемных конструкций). Обследование пациентов проводилось по общепринятой методике, включающей сбор жалоб, анамнеза жизни, анамнеза заболевания, внешнего осмотра и локально полости рта с использованием стандартного набора стоматологических инструментов.
Состояние слизистой оболочки оценивалось при естественном освещении с учетом цвета, рельефа, влажности, тургора. Осмотр слизистой оболочки полости рта производился в направлении от преддверия полости рта к зеву, особое внимание уделялось участкам слизистой оболочки протезного ложа.
Клинический диагноз определялся при частичном отсутствии зубов по классификации Кеннеди, при полном отсутствии зубов на верхней челюсти — по классификации Шредера, на нижней челюсти — по классификации Келлера. Все данные подробно отражены в медицинской карте стоматологического больного (форма No 043/у). Далее проводилась проба Шиллера—Писарева.
Исследования микрофлоры слизистой оболочки протезного ложа
Первое бактериологическое исследование микрофлоры слизистой оболочки протезного ложа проводилось до использования зубной пасты R.O.C.S. Стандартным стерильным ватным тампоном материал снимался со слизистой протезного ложа, после чего его засевали на кровяной агар, сахарный бульон и среду Сабуро для выделения грибов, используя всю поверхность тампона [11]. Посевы инкубировали в термостате при 37°С в течение 24 часов (плотные питательные среды) или 2 сут (бульон). Микроорганизмы идентифицировали по общепринятой схеме. Материал подвергался подсчету колониеобразующих единиц (КОЕ) с идентификацией по бинарной номенклатуре до рода и вида.
Через 2 нед применения зубной пасты было проведено повторное исследование слизистой оболочки протезного ложа (микробиологи-ческое и индексы гигиены).
Результаты и обсуждение
Исследования микрофлоры слизистой оболочки протезного ложа у пациентов, пользующихся съемными зубными протезами, показали следующие результаты:
- Всего было выделено штаммов микроорганизмов — 131.
- При оценке исходного состояния слизистой оболочки протезного ложа выделено 73 штамма микроорганизмов.
- После двухнедельного применения зубной пасты R.O.C.S. выделено 58 штаммов микроорганизмов.
- Общее число выделенных штаммов микроорганизмов в результате применения R.O.C.S. уменьшилось и составило 79,5%.
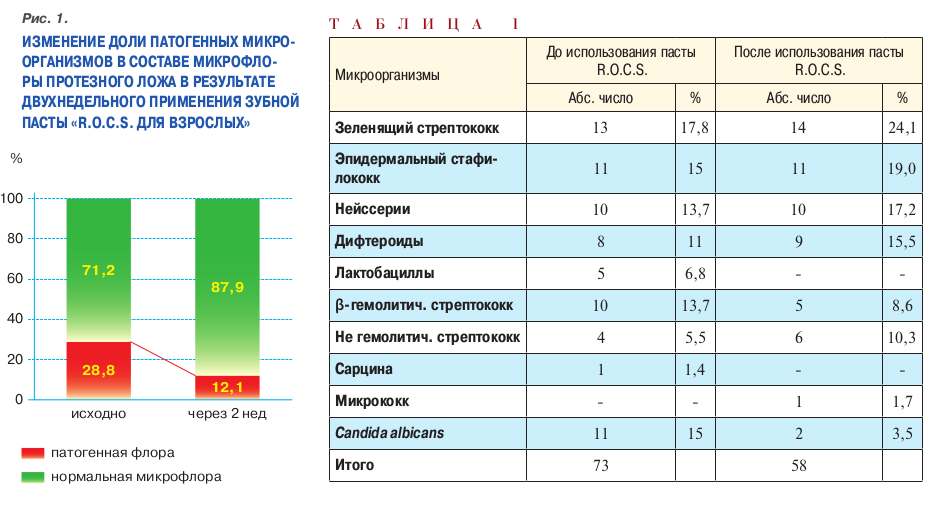
Таким образом, 20,5% микробных штаммов исчезло. Исходно доля патогенной флоры составляла 28,8%. Через 2 нед чистки зубов и протезов пастой R.O.C.S. доля патогенов составила 12,1%. Обращает на себя внимание тот факт, что состав сапрофитной и условно-патогенной микрофлоры практически не изменялся ни количественно, ни качественно. (рис. 1, табл. 1).

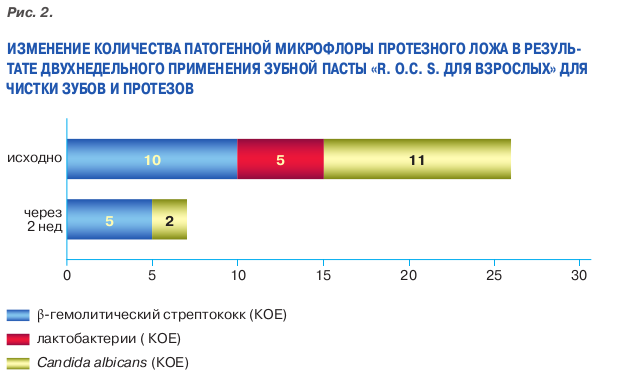
Изменения в составе патогенной микрофлоры (рис 2), зарегистриро ванные после двухнедельного при менения пасты R.O.C.S., коснулись преимущественно кариесогенной флоры. Так, доля β-гемолитичес кого стрептококка снизилось с 13,7 до 8,6%. Уменьшение количества микроорганизмов этого штамма со ставило 37,2% от исходного числа. Лактобациллы после воздействия исследуемой зубной пасты исчезли полностью.

Доля высеивавшихся грибов рода Candida albicans снизилась с 15 до 3,5%. Уменьшение количества Candida albicans составило 76,7% от исходного числа.
Благоприятные изменения в составе микробной флоры коррелировали с улучшением состояния слизистой оболочки протезного ложа. Редукция воспаления слизистой оболочки наблюдалась у 93% пациентов (из 14 пациентов с отечной и гиперемированной слизистой в 13 случаев слизистая оболочка стала бледно-розовой, безболезненной).
Основой профилактики и лечения инфекций слизистой оболочки протезного ложа является правильная гигиена полости рта и надлежащий уход за съемными протезными конструкциями.
Полученные в ходе исследования результаты позволяют сформулировать следующие выводы:
- Использование для гигиены полости рта и чистки протезов зубной пасты «R.O.C.S. для взрослых», позволяет за достаточно короткий промежуток времени (2 нед) добиться существенных позитивных изменений в составе микрофлоры слизистой оболочки протезного ложа.
- Изменения в составе нормальной микрофлоры, зарегистрированные в ходе исследования, не значительны. Доля патогенных микроорганизмов в составе микрофлоры слизистой оболочки протезного ложа уменьшилась в 2,4 раза.
- Применение «R.O.C.S. для взрослых» позволило на 76% уменьшить количество высеиваемых штаммов Candida albicans, а у большинства пациентов удалось полностью элиминировать этот штамм. Данный факт позволяет рассматривать зубную пасту R.O.C.S. как эффективное средство устранения Candida albicans, не обладающее побочными действиями, свойственными фунгицидным препаратам.
- Высокая противовоспалительная эффективность зубной пасты «R.O.C.S. для взрослых» позволяет быстро устранить воспалительные явления в слизистой протезного ложа у большинства пациентов (93% случаев).
- Полученные в ходе клинического исследования результаты позволяют рекомендовать зубную пасту «R.O.C.S. для взрослых» для постоянного гигиенического ухода пациентам, пользующимся частичными и полными съемными зубными протезами, поскольку никаких побочных эффектов при менения выявлено не было, а все зарегистрированные изменения состава микрофлоры можно трактовать как позитивные.
- Жолудев С.Е. Маренкова М.Л. Применение антисептических растворимых таблеток для ухода за съемными пластинчатыми протезами. // Пародонтология No 2(31), 2004
- Пэнкхост К. Кандидозный стоматит. Поискданных в октябре 2001 г. www.mediasphera.ru/clinicalevidence/PDF/Part7/3_Zabol_polosti_rta/3‐2.pdf
- Щербаков А.С. с соавт. Клиническое изу‐чение эффективности очищения и дезинфекциисъемных протезов. // Стоматология, No 4, 2001
- Царев В.Н. с соавт. Динамика колонизации микробной флорой полости рта различных матери‐ алов, используемых для зубного протезирования. // Стоматология, No1, 2000
- Ростока Д. Адгезия Candida albicans к кор‐ ригирующим пластмассам, используемым при ортопедическом лечении съемными протезами. // Стоматология, No4, 2004
- Левкин В.А. Осложнения при протезирова‐ нии частичными съемными пластиночными проте‐ зами и их профилактика // Аномалии и деформа‐ ции зубочелюстной системы: Сб. науч. тр./ — М., 1992. — С. 33—37.
- Kraft J. et al. Einfluo von Prothesenhaftmitteln aut das Wachstum von Candida species (In—vivo— Untersuchungen) // Dtsch. Zahnorztl. Z. — 1984. — Bd.39. — S. 855—857.
- Шумский А.В. Выбор фунгицидных препа‐ ратов для лечения кандидоза слизистой оболоч‐ ки полости рта и губ. // Стоматология No 3, 1999, с. 19—21
- Rerknimitr R. et al. / Results of gastroscope bacterial decontamination by enzymatic detergent compared to chlorhexidine. // World J Gastroenterol. 2006 Jul 14;12(26):4199-4202.
- Афиногенов Г.Е. и соавт. Антиадгезивная ак‐ тивность зубных паст. // Клиническая стоматология No 3, 2005.
- Борисов Л.Б. и соавт. Руководство к лабора‐ торным занятиям по медицинской микробиологии, вирусологии и иммунологии. М., Медицина, 1993, с. 236—239.
- Жолудев С.Е. Клиника, диагностика, лечение и профилактика явлений непереносимости акри‐ ловых зубных протезов Автореферат дисс. ... докт. мед. наук. Екатеринбург, 1998. — 40 с.
Характеристики
|
Автор книги
|
Л. Р. Сарап, Л. Ю. Бутакова, Ю. А. Зенкова, С. К. Матело, Т. В. Купец |
|
Год выпуска
|
2007 |
Задать вопрос
Задать вопрос
Новости
Все новости
25 марта 2025
Образовательное кредитование: пособие для студентов СПО
20 октября 2023
Кредит на образование с господдержкой




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
