РЕЗУЛЬТАТЫ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ДЕНТАЛЬНОГО ПЕРИИМПЛАНТИТА
Нет в наличии
Описание
АННОТАЦИЯ
Проведены клинико-лабораторные исследования у 26 больных дентальным периимплантитом I-II степени тяжести после направленной регенерации костной ткани с коррекцией локальных иммунологических нарушений и биоцидной функции слизистой оболочки полости рта. Цель исследования - изучить клинические, этиологические и патогенетические особенности возникновения дентального периимплантита и разработать на этой основе оптимальные схемы лечения данного заболевания. Предложен новый концептуальный подход к патогенетическому, терапевтическому и хирургическому лечению дентального периимплантита, предусматривающий использование антибиотиков кратковременным курсом (3-4дня), пробиотика Биоспорина, иммунокорректора Реоферона, остеотропных средств местного и общего действия, изолирующих резорбируемых мембран (a-PRF и полимолочной кислоты). Установленно, что прогнозирование исходов реконструктивно-регенративного лечения дентального периимплантита возможно на основании изменения содержания в ротовой жидкости уровней SIgA и Ил-1β. Комбинированная комплексная терапия больных дентальным периимплантитом позволила добиться стойкого клинико-лабораторного выздоровления у 94,4% больных; при традиционном лечении- у 75% пациентов.
Ключевые слова: периимплантит, биоценоз, иммунодефицит, направленная регенерация костной ткани.
В настоящее время дентальная внутрикостная имплантация получила широкое и повсеместное применение в стоматологической практике, благодаря чему открылись новые возможности для повышения качества устранения различных дефектов зубных рядов [1, c. 211; 2, c. 356].
Однако, несмотря на неоспоримые успехи современной имплантологии, на сегодняшний день, наиболее актуальными и сложными, для практического здравоохранения, остаются вопросы лечения воспалительных осложнений, возникших в отсроченном периоде после дентальной имплантации, т.к. их появление негативно влияет на сохранность самих имплантатов. Так, по данным анализа публикаций последних лет, в результате возникших патологических изменений в тканях, окружающих внутрикостный имплантат, случаи неудачных исходов лечения в среднем составляют от 4% до 12%, а по данным некоторых авторов достигают 43% [3, c. 59- 64; 4, c. 205-210; 5, c. 94-97].
Неоспоримым является тот факт, что надежное функционирование дентальных имплантатов зависит от индивидуального состояния организма, гигиены полости рта и связано с отсутствием воспалительно-деструктивных явлений в периимплантационной зоне после установки имплантов. Не исключено, что именно конкретные нарушения биоценоза десневых тканей и локальной иммунной защиты создают все предпосылки для формирования патогенетического фона на котором и происходит развитие затяжных воспалительно-деструктивных процессов в периимплантационном участке при дентальных периимплантитах. С этих позиций, представляет интерес, изучение количественных изменений показателей микробиоценоза периимплантационной зоны, уровня местного иммунитета в динамике наблюдений у данной категории больных. Предстоит выяснить могут ли они служить в качестве объективных критериев (предикторов) исходов дентальной внутрикостной имплантации [6, c. 218-226; 7, c. 339-344; 8, c. 281-285].
В настоящее время имеющиеся научно-методические и клинические подходы к лечению дентального периимплантита предусматривают воздействия на ведущие этиопатогенетические звенья дентального периимплантита и базируются в основном на проведении периодических курсов рациональных гигиенических мероприятий и использовании местной антибактериальной терапии хлоргексидин-содержащими средствами, реже антибиотиками. В последнее время особое внимание стало уделяться вопросам коррекции иммунологических расстройств, сопровождающих воспалительные процессы в периимплантационной зоне [9, c. 134-140; 10, c. 21-42; 11, c. 94-97].
В свете новых знаний о физиологических процессах костного метаболизма, механизмах формирования резорбтивных явлений в костных тканях и новых возможностях их верификации сформировались представления о необходимости включения в комплексное лечение воспалительно-деструктивных заболеваний средств, стимулирующих остеогенез. Несмотря на это, не все врачи-имплантологи учитывают это положение при проведении регенеративно-реконструктивного лечения дентального периимплантита. С этим обстоятельством, по-видимому, связана недостаточная эффективность устранения патологических явлений вокруг импланта, что создает предпосылки к формированию рецидивов активного воспалительно-деструктивного процесса в периимплантационной области и сведению «на нет» остеоинтеграции имплантата.
Таким образом, становится очевидным, что даже качественно проведенная профессиональная гигиена и местная антибиотикотерапия не всегда обеспечивает успех лечения воспалительных осложнений дентальной имплантации и, как правило, должна сочетаться с проведением лечебных мероприятий, направленных на нормализацию биоценоза десневых тканей, показателей иммунной защиты, а также на стимуляцию процессов костного метаболизма. Все вышеизложенное заставляет развивать не только гигиеническое и этиотропное направление в лечении дентального периимплантита, но и всесторонне изучать возможности патогенетической терапии.
Цель исследования - изучить клинические, этиологические и патогенетические особенности возникновения дентального периимплантита и разработать на этой основе оптимальные схемы лечения данного заболевания.
Материалы и методы исследования
Проведено комплексное клинико-лабораторное обследование 26 больных, планомерно отобранных на консультативном приеме в течении 2 лет с подтвержденным диагнозом дентальный периимплантит I и II степени тяжести, в возрасте от 34 до 59 лет. Среди больных мужчин было 46,2%, женщин 53,8%. У подавляющего числа (у 85,2%) возраст варьировал в диапазоне от 45 до 56 лет.
Контрольную группу составили 19 практически здоровых доноров-добровольцев. В исследования не включались лица имеющие сопутствующие заболевания основных систем и органов (респираторные, сердечно-сосудистые, эндокринные, нервные), а также больные страдающие наркоманией, алкоголизмом, пациенты с основными показателями крови ниже нормальных значений.
Все пациенты подвергались общепринятому клиническому обследованию, обучались контролируемой гигиене полости рта.
Стоматологический статус оценивали после изучения жалоб, анамнеза, осмотра челюстно-лицевой области с оценкой состояния зубов и зубных рядов, слизистой оболочки полости рта, височнонижнечелюстного сустава и прикуса.
Клиническое обследование пациентов включало изучение гигиенического состояния полости рта, особое внимание уделяли изучению зоны имплантации, анализировали степень кровоточивости десен. Для цифровой оценки гигиенического состояния применяли метод Green-Vermillion, для оценки состояния и степени воспаления десны в периимплантационной области – метод Мюллемана в модификации Коуэлла. При этом использовали оценочную шкалу от «0» до «3» баллов.
Величину рецессии десны измеряли от «шейки» импланта до уровня края десны. Использовали критерии оценки рецессии в диапазоне от 0 до 5 баллов.
Для измерения глубины периимплантных карманов, определения поддесневых отложений на имплантах использовали специальный градуированный зонд с ценой деления 0,1 мм. Конец зонда мягко продвигали между имплантатом и десной до ощущения сопротивления. Глубина периимплантных карманов измерялась с четырех сторон имплантата (дистальной, медиальной, вестибулярной, оральной). Обнаруженный наиболее глубокий карман и определял окончательную оценку исследования.
Всем больным проводили рентгенографическое исследование периимплантной области, в частности альвеолярного отростка в целом, используя прицельные внутриротовые снимки или ортопантомограммы. По необходимости, у части пациентов, кроме традиционной ортопантомографии, изучали и учитывали особенности рентгенографической картины на томограммах челюстей.
Микробиологические исследования включали определение качественного состава микробных ассоциаций в периимплантной эконише. В работе использовался классический бактериологический метод и метод полимеразной цепной реакции (ПЦР) с последующей обратной ДНК гибридизацией набором реагентов «MicroDent®» (Германия) согласно инструкций производителя.
Для оценки состояния местного гуморального иммунитета полости рта проводили определение содержания SIgA, IgG и IgM в смешанной нестимулированной слюне методом радиального иммуноферментного анализа с использованием моноспецифических антисывороток к названным иммуноглобулинам тест-системой «Сорбент» (Россия) по стандартной методике согласно рекомендаций производителя. Слюну в количестве 10 мл собирали утром натощак путем сплевывания в стерильные пробирки.
Уровень содержания в ротовой жидкости ИЛ1β и ИЛ-4 оценивали с помощью метода твердофазного иммуноферментного анализа с использованием коммерческих наборов фирмы Pro-Con (НПО «Протеиновый контур» г. Санкт-Петербург). Иммуноферментный анализ осуществляли строго по протоколу, предложенному разработчиками тест системы.
Комплексное лечение больных дентальным периимплантитм осуществляли в 2 этапа. На I этапе проводилось обучение правилам гигиенического ухода за полостью рта с особым акцентом на периимплантные зоны и супраконструкции на имплантах. Параллельно проводили профессиональные гигиенические мероприятия, антибактериальную и иммунокоррегирующую терапию.
Исходя из принципов доказательной медицины на начальном этапе использования перечисленных лекарственных средств пациенты, страдающие дентальным периимплантитом были разделены на две группы равноценные по возрасту, полу и тяжести заболевания: основную группу (18 чел.) и группу сравнения (8 чел.).
Поскольку, в этиологии дентального периимплантита (как было установлено нами) доминирующая роль принадлежит пародонтогенным возбудителям, довольно часто в ассоциации с грибами рода Кандида, мы полагали, что оптимальной схемой для устранения и коррекции дисбиотических состояний полости рта, обуславливающих развитие воспалительно-деструктивного процесса вокруг имплантата, может являться комбинированное применение у больных основной группы антибиотика ципрофлоксацина и спорового пробиотика биоспорина. Антибиотики назначались по 1 грамму кратковременным курсом в течении 2-3 дней за сутки до оперативного лечения. Биоспорин вводили ректально по 1 суппозитории, на протяжении 8-9 дней. Пациенты группы сравнения в качестве общей антибактериальной терапии получали «Амоксиклав», по общепринятой схеме.
Учитывая, что у больных дентальным периимплантитом выявлен выраженный иммунодефицит местного секреторного иммунитета и дисбаланс в функционировании цитокиновой системы для коррекции иммунных нарушений у больных основной группы был избран «Реоферон» применяемый при лечении многих патологических процессов с названными нарушениями. У больных группы сравнения – традиционный иммуномодулятор – «Циклоферон». На 2-м этапе лечения проводилось устранение периимплантных карманов. У больных основной группы и группы сравнения проводились лоскутные операции.
Хирургическое лечение больных, страдающих дентальным периимплантитом, в обеих группах пациентов проводили по единому, общепринятому протоколу: очищали супраконструкции от мягкого налета и твердых зубных отложений, удаляли кромочный эпителий, грануляции и гипертрофированную часть слизистой оболочки при помощи лазера. У больных основной группы реконструкцию утраченных костных тканей проводили по методике направленной тканевой регенерации с использованием материала «Bio-Oss» (Швейцария) связанного жидким богатым тромбоцитами фибрином (i-PRF) и изолирующих мембран, полученных из тромбоцитарной массы (a-PRF) крови пациента. В ряде случаев использовали мембраны из полимолочной кислоты. Заполнение костного дефекта остеоиндуктивным материалом проводилось по следующей методике: у больного осуществляли забор крови из локтевой вены и смешивали ее с ксеноматериалом «Bio-Oss». Полученную смесь вносили в костный дефект, пропитывали i-PRF, изолировали a-PRF мембранами, следом адаптировали и ушивали лоскуты.
Для ускорения восстановления костных структур альвеолярной кости больным основной группы по завершению хирургических вмешательств назначали остеотропный препарат нового поколения «Бивалос» по 1 саше ежедневно, на протяжении 28 дней.
Статистическую обработку полученных данных проводили на персональном компьютере с вычислением средней арифметической (M), среднего квадратического отклонения средней ошибки средней арифметической (m), t –критерия Стьюдента, коэффициента достоверности различий (р). Достоверные различия считали при р<0,05.
Результаты и их обсуждение
При поступлении в клинику все больные предъявляли жалобы на незначительную боль десневых тканей в области имплантов, непостоянного характера, возникающие чаще всего вовремя либо после приема пищи. Объективно выявлялись обильные отложения зубного налета и зубного камня на ортопедических супраконструкциях на имплантах. Индекс гигиены полости рта соответствовал 2,9±0,23, а индекс кровоточивости десен в зоне импланта в среднем был равен 2,2±0,12. При пальпации выделялось незначительное количество экссудата. Определялись периимплантные карманы глубиной от 3 до 5 мм. Рентгенографически на ортопантомограммах обнаруживалась рецессия костной ткани в пределах 3-4 мм, регистрировалось отсутствие плотной компактной пластинки в верхней части имплантата, что указывало на нарушение процесса остеоинтеграции у данной категории больных.
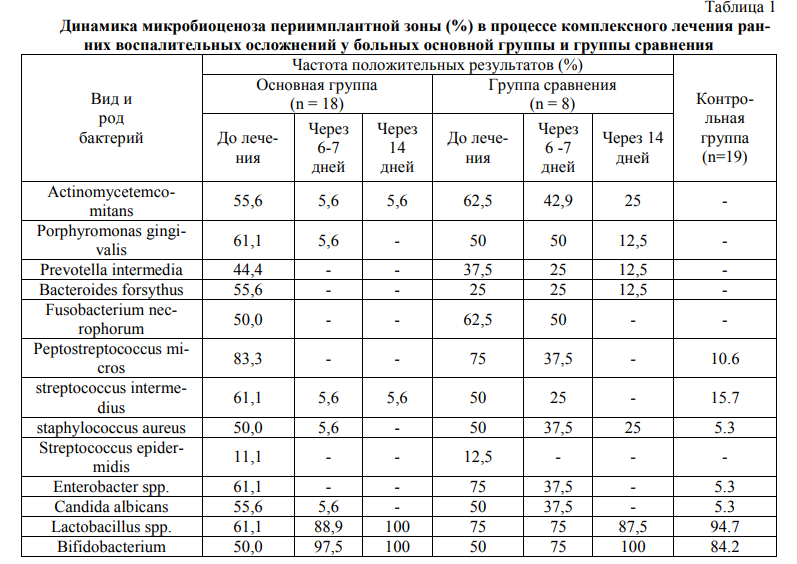
При изучении видового состава микрофлоры у больных дентальным периимплантитом в периимплантной зоне выявлен полимикробный состав в котором преобладали анаэробные бактерии, в том числе пародонтогенные представители флоры Actinobacillus actinomycetemcomitans, Prevotella intermedia, Porphyromonas gingivalis, Bacteroides forsythus. Важно отметить, что обсеменение названными микроорганизмами периимплантных тканей, происходит на фоне отсутствия или снижения количества лакто- и бифидобактерий (Табл. 1).
Дальнейшие исследования позволили установить, что особое место в патогенезе дентального периимплантита занимают нарушения в системе местного гуморального иммунитета. Обнаружено резкое снижение продукции SIgA в смешанной слюне у 16 (88,9%) больных и умеренное у 2 (11,1%) пациентов (в среднем 0,34±0,02г/л) (Табл. 2).
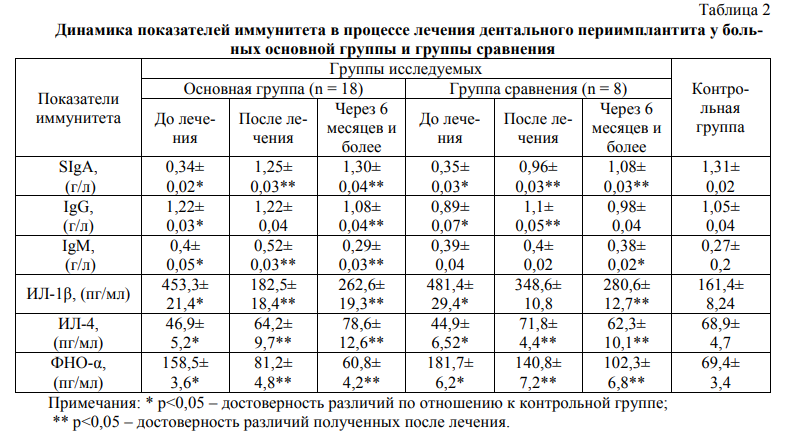
При исследовании цитокинового статуса у больных дентальным периимплантитом обнаружено значительное повышение уровней провоспалительных интерлейкинов ИЛ-1β и ФНО-α (соответственно в 2,9 раза и в 2,5 раза) в слюне на фоне мало измененной продукции противовоспалительного цитокина ИЛ-4 в сторону снижения (в 1,5 раза по сравнению с показателем контрольной группы).
Выявленое умеренное повышение ИЛ-1β и его синергиста ФНО-α, обычно сопутствует хроническому воспалению, а резкое повышение - указывает на активацию воспалительной реакции и резорбтивного процесса в костных структурах.
При оценке эффективности лечебных комплексов обеих групп была выявлена существенная разница. Регрессия клинических признаков дентального периимплантита под влиянием разработанной системы медикаментозного лечения достигалась у подавляющего большинства больных. Так, к 6-7 дню лечения ликвидация воспалительного процесса в периимплантной зоне отмечена у 88,9% пациентов основной группы и 50% группы сравнения. По истечении 14 суток после оперативных вмешательств сокращались симптомы воспаления у одного пациента (5,6% случаев) основной группы и у 3 (37,5%) представителей группы сравнения.
Было установлено, что в результате использования предложенной нами методики комплексного лечения дентального периимплантита у пациентов основной группы существенно снижалась частота выявления условно-патогенных микроорганизмов, заселяющих периимплантные участки. Так, если у пациентов группы сравнения было выявлено, что в очагах воспаления к 6-7 дню лечения сохранились все те же виды патогенной микрофлоры (основные виды пародонтопатогенных инфекций, включая грибы рода Кандида, актиномицеты и фузобактерии) более чем у 40% больных, то у 77,8% пациентов основной группы под влиянием разработанного лечебно-профилактического комплекса в эти сроки имело место полное исчезновение большинства представителей патогенной флоры и грибов; отмечено резкое снижение количества других представителей микрофлоры в биологическом материале, взятом из периимплантных участков.
Полная элиминация предполагаемых возбудителей заболевания отмечена при использовании разработанного нами лечебного комплекса к концу второй недели у 94,4% больных, у одного (5,6%) пациента в периимплантной зоне обнаруживались только бактерии рода A. Actinomycentcomitans и Str. Intermedius. В этот период у пациентов группы сравнения микробный пейзаж периимплантных участков хотя и претерпевал существенных изменений, но в очагах воспаления сохранялись те же виды (особенно пародонтальные микроорганизмы и стафилококки) более чем у 40% исследуемых.
Как показал дальнейший анализ полученных результатов, положительное влияние разработанного лечебного комплекса, используемого при лечении дентального периимплантита у больных основной группы, было связано не только со способностью ликвидировать патогенную флору, но и вызывать стойкую нормализацию показателей местного гуморального иммунитета, интерлейкинового статуса и процессов костного ремоделирования.
Под действием лечебного комплекса у представителей основной группы нормализация уровней SIgA, IgG, IgM наступила у 94,4% больных к 20-25 дню после оперативных вмешательств. У больных группы сравнения к этому периоду положительные сдвиги в системе иммуноглобулинов слюны были несколько худшими (соответственно 0,96±0,03 г/л, 1,1±0,05 г/л и 0,4 ±0,02 г/л против 1,25±0,03 г/л, 1,22±0,04 г/л и 0,52±0,03 г/л у больных основной группы).
Полнота коррегирующих эффектов по отношению интерлейкинов отмечалась в большей мере также у больных основной группы. После проведенной терапии параметры содержания ИЛ-1β в слюне пациентов основной группы снизились до нормальных значений (соответственно до 182,5±18,4 пг/мл). Более, чем у половины пациентов группы сравнения отмечалась не полная нормализация анализируемого показателя, что сказалось на усредненных показателях в целом: они оказались статистически более высокими, чем у пациентов основной группы (348,6±10,8 пг/мл; р<0,05).
При контрольном осмотре у всех пациентов основной группы, а также у 75% больных группы сравнения через 1, 6 и 12 месяцев отмечено улучшение местного статуса: отсутствовала гиперемия тканей десны и межзубных десневых сосочков в области имплантатов, ткани десневой манжетки стали плотнее, выделений экссудата не наблюдалось, индекс кровоточивости соответствовал здоровому пародонту. Значения индексов гигиены свидетельствовали о хорошем гигиеническом состоянии полости рта. Согласно полученным данным, в поздние сроки наблюдений более значимо уменьшалась глубина костных карманов в области имплантатов у лиц основной группы, о чем свидетельствует среднее значение до лечения, через 6 и 12 месяцев. До лечения средние значения составляли в основной группе 3,04±0,1 мм, в группе сравнения 3,16±0,2 мм, после лечения через 6 месяцев соответственно 0,52±0,1 мм и 1,04±0,3 мм. Характерно, что спустя 12 месяцев после лечения этот показатель в основной группе изменялся не существенно. В то время как у больных группы сравнения средние показатели глубины периимплантных карманов увеличились за счет рецидива периимплантита у 2 пациентов и составили соответственно 1,81±0,4 мм против 0,51±0,1 мм в основной группе.
На рентгенограмме через 6-12 месяцев не отмечалось ни в одном случае увеличение деструкции кости. Контуры альвеолярного отростка стали более четкими, не выявлялись очаги остеопороза. В области периимплантных дефектов рентгенографическая картина свидетельствовала о приросте костной ткани у 94,4% больных основной группы и у 75% пациентов группы сравнения.
Таким образом, разработанный с учетом патогенетических механизмов развития заболевания комбинированный метод лечения дентального периимплантита является высокоэффективным, способствует существенному сокращению реабилитационного периода, купированию воспалительнодеструктивных явлений и интенсификации репаративно-регенераторных процессов в периимплантном участке в отдаленные сроки после проведенных хирургических вмешательств.
Выводы
1. Микроэтиологические нарушения в периимплантной зоне у больных дентальным периимплантитом характеризовались доминированием анаэробной условно патогенной флоры в ассоциации с основными пародонтальными бактериями и грибами рода Кандида. Их следует рассматривать как этиологически значимые возбудители заболевания.
2. Дентальный периимплантит сопровождается снижением биоцидности слизистой оболочки полости рта: падением уровней SIgA в слюне более чем в 3,7 раза. Секреторная активность слизистых ротовой полости характеризуется также высокой продукцией ИЛ-1β и ФНО-α, что свидетельствует о наличии активной воспалительной реакции в периимплантной зоне и усилением резорбтивных процессов в костных структурах, окружающих имплант.
3. Комбинированная терапия больных дентальным периимплантитом, предусматривающая использование ципрофлоксацина кратковременными курсами с последующим назначением пробиотика биоспорина, иммунокорректора реоферона и остеотропного препарата «Бивалос», позволила добиться стойкого (не менее 2 лет) клинико-лабораторного выздоровления у 94,4% больных; при традиционном лечении- у 75% пациентов.
4. В комплексных программах прогнозирования исходов лечения дентального периимплантита следует наряду с клинико-рентгенографическими данными использовать прогностически значимые показатели SIgA, ИЛ-1β, ФНО-α и ИЛ-4.
Литература
1. Васильев А.В. Практические аспекты клинической дентальной имплантологии / А.В. Васильев, С.Б. Улитовский, Н.В. Васильев // Атлас-руководство.-Человек.- 2010.-С. 211.
2. Параскевич В.Л. Дентальная имплантология / В.Л. Параскевич // Основы теории и практики.- Минск.- 2002.-С.356.
3. Mesmer C. Clinical, microbiological and immunological findings in peri-implantitis patients with bar-retained lower removable partial dentures, compared to a healthy control group (12-month-follow-up) / C. Mesmer, A. Forster, M. Antal, K. Nagy // Fogorv Sz.-2012.-№105.-P.59-64.
4. Heirz-Mayfild L. Anti-infective surgical therapy of periimplantitis. A 12-month prospecrive clinical study / L. Heirz-Mayfild, G. Salvi, A. Mombelli, et al. // Clin Oral Implants Res.-2012.-№23.-P.205-210.
5. Jeleznyi S. Prevention of infectious complications in dental implantation. Actual problems of dentistry and maxillofacial surgery / S. Jeleznyi, V. Tolmachev, S. Nosov // J. Scientific and practical materials.- 2007.-P. 94-97.
6. Koyanagi T. Comprehensive microbiological findings in periimplantitis and periodontitis / T. Koyanagi, M. Sakamoto, Y. Takeuchi1, N. Maruyama // J. Clinical Periodontology.-2013.-№40.-P.218-226.
7. Vered Y. Teeth and implant surroundings: Clinical health indices and microbiologic parameters / Y. Vered, A. Zini, J. Mann // J. Quintessence International.-2011.-№42.-P.339-344.
8. Lindhe J. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology / J. Lindhe, J. Meyle. // J. Clin Periodontol.- 2008.-№35.-P.281-285.
9. Verardi S. Peri-implantitis fibroblasts respond to host immune factor C1q. / S/ Verardi, M. Quaranta, S. Bordin // J. Periodont.-2011.- №46.-P.134–140.
10. Esposito M. Treatment of periimplantitis: what interventions are effective? A Cochrane systematic review / M. Esposito, M.G. Grusovin, H.V. Worthington // Oral Implantol.-2012.-№5.-P.21-41.
Проведены клинико-лабораторные исследования у 26 больных дентальным периимплантитом I-II степени тяжести после направленной регенерации костной ткани с коррекцией локальных иммунологических нарушений и биоцидной функции слизистой оболочки полости рта. Цель исследования - изучить клинические, этиологические и патогенетические особенности возникновения дентального периимплантита и разработать на этой основе оптимальные схемы лечения данного заболевания. Предложен новый концептуальный подход к патогенетическому, терапевтическому и хирургическому лечению дентального периимплантита, предусматривающий использование антибиотиков кратковременным курсом (3-4дня), пробиотика Биоспорина, иммунокорректора Реоферона, остеотропных средств местного и общего действия, изолирующих резорбируемых мембран (a-PRF и полимолочной кислоты). Установленно, что прогнозирование исходов реконструктивно-регенративного лечения дентального периимплантита возможно на основании изменения содержания в ротовой жидкости уровней SIgA и Ил-1β. Комбинированная комплексная терапия больных дентальным периимплантитом позволила добиться стойкого клинико-лабораторного выздоровления у 94,4% больных; при традиционном лечении- у 75% пациентов.
Ключевые слова: периимплантит, биоценоз, иммунодефицит, направленная регенерация костной ткани.
В настоящее время дентальная внутрикостная имплантация получила широкое и повсеместное применение в стоматологической практике, благодаря чему открылись новые возможности для повышения качества устранения различных дефектов зубных рядов [1, c. 211; 2, c. 356].
Однако, несмотря на неоспоримые успехи современной имплантологии, на сегодняшний день, наиболее актуальными и сложными, для практического здравоохранения, остаются вопросы лечения воспалительных осложнений, возникших в отсроченном периоде после дентальной имплантации, т.к. их появление негативно влияет на сохранность самих имплантатов. Так, по данным анализа публикаций последних лет, в результате возникших патологических изменений в тканях, окружающих внутрикостный имплантат, случаи неудачных исходов лечения в среднем составляют от 4% до 12%, а по данным некоторых авторов достигают 43% [3, c. 59- 64; 4, c. 205-210; 5, c. 94-97].
Неоспоримым является тот факт, что надежное функционирование дентальных имплантатов зависит от индивидуального состояния организма, гигиены полости рта и связано с отсутствием воспалительно-деструктивных явлений в периимплантационной зоне после установки имплантов. Не исключено, что именно конкретные нарушения биоценоза десневых тканей и локальной иммунной защиты создают все предпосылки для формирования патогенетического фона на котором и происходит развитие затяжных воспалительно-деструктивных процессов в периимплантационном участке при дентальных периимплантитах. С этих позиций, представляет интерес, изучение количественных изменений показателей микробиоценоза периимплантационной зоны, уровня местного иммунитета в динамике наблюдений у данной категории больных. Предстоит выяснить могут ли они служить в качестве объективных критериев (предикторов) исходов дентальной внутрикостной имплантации [6, c. 218-226; 7, c. 339-344; 8, c. 281-285].
В настоящее время имеющиеся научно-методические и клинические подходы к лечению дентального периимплантита предусматривают воздействия на ведущие этиопатогенетические звенья дентального периимплантита и базируются в основном на проведении периодических курсов рациональных гигиенических мероприятий и использовании местной антибактериальной терапии хлоргексидин-содержащими средствами, реже антибиотиками. В последнее время особое внимание стало уделяться вопросам коррекции иммунологических расстройств, сопровождающих воспалительные процессы в периимплантационной зоне [9, c. 134-140; 10, c. 21-42; 11, c. 94-97].
В свете новых знаний о физиологических процессах костного метаболизма, механизмах формирования резорбтивных явлений в костных тканях и новых возможностях их верификации сформировались представления о необходимости включения в комплексное лечение воспалительно-деструктивных заболеваний средств, стимулирующих остеогенез. Несмотря на это, не все врачи-имплантологи учитывают это положение при проведении регенеративно-реконструктивного лечения дентального периимплантита. С этим обстоятельством, по-видимому, связана недостаточная эффективность устранения патологических явлений вокруг импланта, что создает предпосылки к формированию рецидивов активного воспалительно-деструктивного процесса в периимплантационной области и сведению «на нет» остеоинтеграции имплантата.
Таким образом, становится очевидным, что даже качественно проведенная профессиональная гигиена и местная антибиотикотерапия не всегда обеспечивает успех лечения воспалительных осложнений дентальной имплантации и, как правило, должна сочетаться с проведением лечебных мероприятий, направленных на нормализацию биоценоза десневых тканей, показателей иммунной защиты, а также на стимуляцию процессов костного метаболизма. Все вышеизложенное заставляет развивать не только гигиеническое и этиотропное направление в лечении дентального периимплантита, но и всесторонне изучать возможности патогенетической терапии.
Цель исследования - изучить клинические, этиологические и патогенетические особенности возникновения дентального периимплантита и разработать на этой основе оптимальные схемы лечения данного заболевания.
Материалы и методы исследования
Проведено комплексное клинико-лабораторное обследование 26 больных, планомерно отобранных на консультативном приеме в течении 2 лет с подтвержденным диагнозом дентальный периимплантит I и II степени тяжести, в возрасте от 34 до 59 лет. Среди больных мужчин было 46,2%, женщин 53,8%. У подавляющего числа (у 85,2%) возраст варьировал в диапазоне от 45 до 56 лет.
Контрольную группу составили 19 практически здоровых доноров-добровольцев. В исследования не включались лица имеющие сопутствующие заболевания основных систем и органов (респираторные, сердечно-сосудистые, эндокринные, нервные), а также больные страдающие наркоманией, алкоголизмом, пациенты с основными показателями крови ниже нормальных значений.
Все пациенты подвергались общепринятому клиническому обследованию, обучались контролируемой гигиене полости рта.
Стоматологический статус оценивали после изучения жалоб, анамнеза, осмотра челюстно-лицевой области с оценкой состояния зубов и зубных рядов, слизистой оболочки полости рта, височнонижнечелюстного сустава и прикуса.
Клиническое обследование пациентов включало изучение гигиенического состояния полости рта, особое внимание уделяли изучению зоны имплантации, анализировали степень кровоточивости десен. Для цифровой оценки гигиенического состояния применяли метод Green-Vermillion, для оценки состояния и степени воспаления десны в периимплантационной области – метод Мюллемана в модификации Коуэлла. При этом использовали оценочную шкалу от «0» до «3» баллов.
Величину рецессии десны измеряли от «шейки» импланта до уровня края десны. Использовали критерии оценки рецессии в диапазоне от 0 до 5 баллов.
Для измерения глубины периимплантных карманов, определения поддесневых отложений на имплантах использовали специальный градуированный зонд с ценой деления 0,1 мм. Конец зонда мягко продвигали между имплантатом и десной до ощущения сопротивления. Глубина периимплантных карманов измерялась с четырех сторон имплантата (дистальной, медиальной, вестибулярной, оральной). Обнаруженный наиболее глубокий карман и определял окончательную оценку исследования.
Всем больным проводили рентгенографическое исследование периимплантной области, в частности альвеолярного отростка в целом, используя прицельные внутриротовые снимки или ортопантомограммы. По необходимости, у части пациентов, кроме традиционной ортопантомографии, изучали и учитывали особенности рентгенографической картины на томограммах челюстей.
Микробиологические исследования включали определение качественного состава микробных ассоциаций в периимплантной эконише. В работе использовался классический бактериологический метод и метод полимеразной цепной реакции (ПЦР) с последующей обратной ДНК гибридизацией набором реагентов «MicroDent®» (Германия) согласно инструкций производителя.
Для оценки состояния местного гуморального иммунитета полости рта проводили определение содержания SIgA, IgG и IgM в смешанной нестимулированной слюне методом радиального иммуноферментного анализа с использованием моноспецифических антисывороток к названным иммуноглобулинам тест-системой «Сорбент» (Россия) по стандартной методике согласно рекомендаций производителя. Слюну в количестве 10 мл собирали утром натощак путем сплевывания в стерильные пробирки.
Уровень содержания в ротовой жидкости ИЛ1β и ИЛ-4 оценивали с помощью метода твердофазного иммуноферментного анализа с использованием коммерческих наборов фирмы Pro-Con (НПО «Протеиновый контур» г. Санкт-Петербург). Иммуноферментный анализ осуществляли строго по протоколу, предложенному разработчиками тест системы.
Комплексное лечение больных дентальным периимплантитм осуществляли в 2 этапа. На I этапе проводилось обучение правилам гигиенического ухода за полостью рта с особым акцентом на периимплантные зоны и супраконструкции на имплантах. Параллельно проводили профессиональные гигиенические мероприятия, антибактериальную и иммунокоррегирующую терапию.
Исходя из принципов доказательной медицины на начальном этапе использования перечисленных лекарственных средств пациенты, страдающие дентальным периимплантитом были разделены на две группы равноценные по возрасту, полу и тяжести заболевания: основную группу (18 чел.) и группу сравнения (8 чел.).
Поскольку, в этиологии дентального периимплантита (как было установлено нами) доминирующая роль принадлежит пародонтогенным возбудителям, довольно часто в ассоциации с грибами рода Кандида, мы полагали, что оптимальной схемой для устранения и коррекции дисбиотических состояний полости рта, обуславливающих развитие воспалительно-деструктивного процесса вокруг имплантата, может являться комбинированное применение у больных основной группы антибиотика ципрофлоксацина и спорового пробиотика биоспорина. Антибиотики назначались по 1 грамму кратковременным курсом в течении 2-3 дней за сутки до оперативного лечения. Биоспорин вводили ректально по 1 суппозитории, на протяжении 8-9 дней. Пациенты группы сравнения в качестве общей антибактериальной терапии получали «Амоксиклав», по общепринятой схеме.
Учитывая, что у больных дентальным периимплантитом выявлен выраженный иммунодефицит местного секреторного иммунитета и дисбаланс в функционировании цитокиновой системы для коррекции иммунных нарушений у больных основной группы был избран «Реоферон» применяемый при лечении многих патологических процессов с названными нарушениями. У больных группы сравнения – традиционный иммуномодулятор – «Циклоферон». На 2-м этапе лечения проводилось устранение периимплантных карманов. У больных основной группы и группы сравнения проводились лоскутные операции.
Хирургическое лечение больных, страдающих дентальным периимплантитом, в обеих группах пациентов проводили по единому, общепринятому протоколу: очищали супраконструкции от мягкого налета и твердых зубных отложений, удаляли кромочный эпителий, грануляции и гипертрофированную часть слизистой оболочки при помощи лазера. У больных основной группы реконструкцию утраченных костных тканей проводили по методике направленной тканевой регенерации с использованием материала «Bio-Oss» (Швейцария) связанного жидким богатым тромбоцитами фибрином (i-PRF) и изолирующих мембран, полученных из тромбоцитарной массы (a-PRF) крови пациента. В ряде случаев использовали мембраны из полимолочной кислоты. Заполнение костного дефекта остеоиндуктивным материалом проводилось по следующей методике: у больного осуществляли забор крови из локтевой вены и смешивали ее с ксеноматериалом «Bio-Oss». Полученную смесь вносили в костный дефект, пропитывали i-PRF, изолировали a-PRF мембранами, следом адаптировали и ушивали лоскуты.
Для ускорения восстановления костных структур альвеолярной кости больным основной группы по завершению хирургических вмешательств назначали остеотропный препарат нового поколения «Бивалос» по 1 саше ежедневно, на протяжении 28 дней.
Статистическую обработку полученных данных проводили на персональном компьютере с вычислением средней арифметической (M), среднего квадратического отклонения средней ошибки средней арифметической (m), t –критерия Стьюдента, коэффициента достоверности различий (р). Достоверные различия считали при р<0,05.
Результаты и их обсуждение
При поступлении в клинику все больные предъявляли жалобы на незначительную боль десневых тканей в области имплантов, непостоянного характера, возникающие чаще всего вовремя либо после приема пищи. Объективно выявлялись обильные отложения зубного налета и зубного камня на ортопедических супраконструкциях на имплантах. Индекс гигиены полости рта соответствовал 2,9±0,23, а индекс кровоточивости десен в зоне импланта в среднем был равен 2,2±0,12. При пальпации выделялось незначительное количество экссудата. Определялись периимплантные карманы глубиной от 3 до 5 мм. Рентгенографически на ортопантомограммах обнаруживалась рецессия костной ткани в пределах 3-4 мм, регистрировалось отсутствие плотной компактной пластинки в верхней части имплантата, что указывало на нарушение процесса остеоинтеграции у данной категории больных.
При изучении видового состава микрофлоры у больных дентальным периимплантитом в периимплантной зоне выявлен полимикробный состав в котором преобладали анаэробные бактерии, в том числе пародонтогенные представители флоры Actinobacillus actinomycetemcomitans, Prevotella intermedia, Porphyromonas gingivalis, Bacteroides forsythus. Важно отметить, что обсеменение названными микроорганизмами периимплантных тканей, происходит на фоне отсутствия или снижения количества лакто- и бифидобактерий (Табл. 1).

Дальнейшие исследования позволили установить, что особое место в патогенезе дентального периимплантита занимают нарушения в системе местного гуморального иммунитета. Обнаружено резкое снижение продукции SIgA в смешанной слюне у 16 (88,9%) больных и умеренное у 2 (11,1%) пациентов (в среднем 0,34±0,02г/л) (Табл. 2).

При исследовании цитокинового статуса у больных дентальным периимплантитом обнаружено значительное повышение уровней провоспалительных интерлейкинов ИЛ-1β и ФНО-α (соответственно в 2,9 раза и в 2,5 раза) в слюне на фоне мало измененной продукции противовоспалительного цитокина ИЛ-4 в сторону снижения (в 1,5 раза по сравнению с показателем контрольной группы).
Выявленое умеренное повышение ИЛ-1β и его синергиста ФНО-α, обычно сопутствует хроническому воспалению, а резкое повышение - указывает на активацию воспалительной реакции и резорбтивного процесса в костных структурах.
При оценке эффективности лечебных комплексов обеих групп была выявлена существенная разница. Регрессия клинических признаков дентального периимплантита под влиянием разработанной системы медикаментозного лечения достигалась у подавляющего большинства больных. Так, к 6-7 дню лечения ликвидация воспалительного процесса в периимплантной зоне отмечена у 88,9% пациентов основной группы и 50% группы сравнения. По истечении 14 суток после оперативных вмешательств сокращались симптомы воспаления у одного пациента (5,6% случаев) основной группы и у 3 (37,5%) представителей группы сравнения.
Было установлено, что в результате использования предложенной нами методики комплексного лечения дентального периимплантита у пациентов основной группы существенно снижалась частота выявления условно-патогенных микроорганизмов, заселяющих периимплантные участки. Так, если у пациентов группы сравнения было выявлено, что в очагах воспаления к 6-7 дню лечения сохранились все те же виды патогенной микрофлоры (основные виды пародонтопатогенных инфекций, включая грибы рода Кандида, актиномицеты и фузобактерии) более чем у 40% больных, то у 77,8% пациентов основной группы под влиянием разработанного лечебно-профилактического комплекса в эти сроки имело место полное исчезновение большинства представителей патогенной флоры и грибов; отмечено резкое снижение количества других представителей микрофлоры в биологическом материале, взятом из периимплантных участков.
Полная элиминация предполагаемых возбудителей заболевания отмечена при использовании разработанного нами лечебного комплекса к концу второй недели у 94,4% больных, у одного (5,6%) пациента в периимплантной зоне обнаруживались только бактерии рода A. Actinomycentcomitans и Str. Intermedius. В этот период у пациентов группы сравнения микробный пейзаж периимплантных участков хотя и претерпевал существенных изменений, но в очагах воспаления сохранялись те же виды (особенно пародонтальные микроорганизмы и стафилококки) более чем у 40% исследуемых.
Как показал дальнейший анализ полученных результатов, положительное влияние разработанного лечебного комплекса, используемого при лечении дентального периимплантита у больных основной группы, было связано не только со способностью ликвидировать патогенную флору, но и вызывать стойкую нормализацию показателей местного гуморального иммунитета, интерлейкинового статуса и процессов костного ремоделирования.
Под действием лечебного комплекса у представителей основной группы нормализация уровней SIgA, IgG, IgM наступила у 94,4% больных к 20-25 дню после оперативных вмешательств. У больных группы сравнения к этому периоду положительные сдвиги в системе иммуноглобулинов слюны были несколько худшими (соответственно 0,96±0,03 г/л, 1,1±0,05 г/л и 0,4 ±0,02 г/л против 1,25±0,03 г/л, 1,22±0,04 г/л и 0,52±0,03 г/л у больных основной группы).
Полнота коррегирующих эффектов по отношению интерлейкинов отмечалась в большей мере также у больных основной группы. После проведенной терапии параметры содержания ИЛ-1β в слюне пациентов основной группы снизились до нормальных значений (соответственно до 182,5±18,4 пг/мл). Более, чем у половины пациентов группы сравнения отмечалась не полная нормализация анализируемого показателя, что сказалось на усредненных показателях в целом: они оказались статистически более высокими, чем у пациентов основной группы (348,6±10,8 пг/мл; р<0,05).
При контрольном осмотре у всех пациентов основной группы, а также у 75% больных группы сравнения через 1, 6 и 12 месяцев отмечено улучшение местного статуса: отсутствовала гиперемия тканей десны и межзубных десневых сосочков в области имплантатов, ткани десневой манжетки стали плотнее, выделений экссудата не наблюдалось, индекс кровоточивости соответствовал здоровому пародонту. Значения индексов гигиены свидетельствовали о хорошем гигиеническом состоянии полости рта. Согласно полученным данным, в поздние сроки наблюдений более значимо уменьшалась глубина костных карманов в области имплантатов у лиц основной группы, о чем свидетельствует среднее значение до лечения, через 6 и 12 месяцев. До лечения средние значения составляли в основной группе 3,04±0,1 мм, в группе сравнения 3,16±0,2 мм, после лечения через 6 месяцев соответственно 0,52±0,1 мм и 1,04±0,3 мм. Характерно, что спустя 12 месяцев после лечения этот показатель в основной группе изменялся не существенно. В то время как у больных группы сравнения средние показатели глубины периимплантных карманов увеличились за счет рецидива периимплантита у 2 пациентов и составили соответственно 1,81±0,4 мм против 0,51±0,1 мм в основной группе.
На рентгенограмме через 6-12 месяцев не отмечалось ни в одном случае увеличение деструкции кости. Контуры альвеолярного отростка стали более четкими, не выявлялись очаги остеопороза. В области периимплантных дефектов рентгенографическая картина свидетельствовала о приросте костной ткани у 94,4% больных основной группы и у 75% пациентов группы сравнения.
Таким образом, разработанный с учетом патогенетических механизмов развития заболевания комбинированный метод лечения дентального периимплантита является высокоэффективным, способствует существенному сокращению реабилитационного периода, купированию воспалительнодеструктивных явлений и интенсификации репаративно-регенераторных процессов в периимплантном участке в отдаленные сроки после проведенных хирургических вмешательств.
Выводы
1. Микроэтиологические нарушения в периимплантной зоне у больных дентальным периимплантитом характеризовались доминированием анаэробной условно патогенной флоры в ассоциации с основными пародонтальными бактериями и грибами рода Кандида. Их следует рассматривать как этиологически значимые возбудители заболевания.
2. Дентальный периимплантит сопровождается снижением биоцидности слизистой оболочки полости рта: падением уровней SIgA в слюне более чем в 3,7 раза. Секреторная активность слизистых ротовой полости характеризуется также высокой продукцией ИЛ-1β и ФНО-α, что свидетельствует о наличии активной воспалительной реакции в периимплантной зоне и усилением резорбтивных процессов в костных структурах, окружающих имплант.
3. Комбинированная терапия больных дентальным периимплантитом, предусматривающая использование ципрофлоксацина кратковременными курсами с последующим назначением пробиотика биоспорина, иммунокорректора реоферона и остеотропного препарата «Бивалос», позволила добиться стойкого (не менее 2 лет) клинико-лабораторного выздоровления у 94,4% больных; при традиционном лечении- у 75% пациентов.
4. В комплексных программах прогнозирования исходов лечения дентального периимплантита следует наряду с клинико-рентгенографическими данными использовать прогностически значимые показатели SIgA, ИЛ-1β, ФНО-α и ИЛ-4.
Литература
1. Васильев А.В. Практические аспекты клинической дентальной имплантологии / А.В. Васильев, С.Б. Улитовский, Н.В. Васильев // Атлас-руководство.-Человек.- 2010.-С. 211.
2. Параскевич В.Л. Дентальная имплантология / В.Л. Параскевич // Основы теории и практики.- Минск.- 2002.-С.356.
3. Mesmer C. Clinical, microbiological and immunological findings in peri-implantitis patients with bar-retained lower removable partial dentures, compared to a healthy control group (12-month-follow-up) / C. Mesmer, A. Forster, M. Antal, K. Nagy // Fogorv Sz.-2012.-№105.-P.59-64.
4. Heirz-Mayfild L. Anti-infective surgical therapy of periimplantitis. A 12-month prospecrive clinical study / L. Heirz-Mayfild, G. Salvi, A. Mombelli, et al. // Clin Oral Implants Res.-2012.-№23.-P.205-210.
5. Jeleznyi S. Prevention of infectious complications in dental implantation. Actual problems of dentistry and maxillofacial surgery / S. Jeleznyi, V. Tolmachev, S. Nosov // J. Scientific and practical materials.- 2007.-P. 94-97.
6. Koyanagi T. Comprehensive microbiological findings in periimplantitis and periodontitis / T. Koyanagi, M. Sakamoto, Y. Takeuchi1, N. Maruyama // J. Clinical Periodontology.-2013.-№40.-P.218-226.
7. Vered Y. Teeth and implant surroundings: Clinical health indices and microbiologic parameters / Y. Vered, A. Zini, J. Mann // J. Quintessence International.-2011.-№42.-P.339-344.
8. Lindhe J. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology / J. Lindhe, J. Meyle. // J. Clin Periodontol.- 2008.-№35.-P.281-285.
9. Verardi S. Peri-implantitis fibroblasts respond to host immune factor C1q. / S/ Verardi, M. Quaranta, S. Bordin // J. Periodont.-2011.- №46.-P.134–140.
10. Esposito M. Treatment of periimplantitis: what interventions are effective? A Cochrane systematic review / M. Esposito, M.G. Grusovin, H.V. Worthington // Oral Implantol.-2012.-№5.-P.21-41.
Характеристики
|
Автор книги
|
Гударьян А.А., Ширинкин С.В. |
|
Год выпуска
|
2016 |
Задать вопрос
Задать вопрос
Новости
Все новости
25 марта 2025
Образовательное кредитование: пособие для студентов СПО
20 октября 2023
Кредит на образование с господдержкой




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
