ВЗАИМОСВЯЗЬ КЛИНИЧЕСКИХ СТОМАТОЛОГИЧЕСКИХ ВОЗРАСТ-АССОЦИИРОВАННЫХ СИНДРОМОВ И НЕКОТОРЫХ ПРЕДИКТОРОВ СТАРЕНИЯ В ПОЛОСТИ РТА
Нет в наличии
Описание
АННОТАЦИЯ
Актуальность. Старение – важный фактор развития различных заболеваний и функциональной недостаточности. Маркеры старения помогают охарактеризовать процесс старения комплексно. В настоящее время наиболее перспективными являются молекулярные и генетические маркеры старения человека (Molecular/DNA-based markers).
Цель исследования – выявление взаимосвязи между клиническими стоматологическими возраст-ассоциированными синдромами и некоторыми предикторами старения в полости рта.
Материалы и методы. В клиническом исследовании приняли участие 200 пациентов пожилого возраста (60-74 года) в соответствии с классификацией ВОЗ. Пациенты были распределены на три группы в зависимости от выявленного клинического стоматологического синдрома (окклюзионный, пародонтальный, дистрофический). У всех пациентов была получена нестимулированная ротовая жидкость. Иммунохимическое исследование ротовой жидкости включало определение Bcl-2 (B cell lymphoma 2), сaspase 3, сytochrome C, GAPDH (glyceraldehyde 3-phosphate dehydrogenase), сleaved PARP (poly (ADP-ribose) polymerase) и p53 методом мультипараметрического флуоресцентного анализа с магнитными микросферами.
Результаты. В результате проведения иммунохимического исследования ротовой жидкости пациентов было установлено, что наиболее высокая концентрация маркеров апоптоза отмечается у пациентов с дистрофическим синдромом, наиболее низкая – при окклюзионном синдроме. Пародонтальный синдром сопровождается промежуточным уровнем предикторов старения в ротовой жидкости.
Заключение. Определение уровня маркеров апоптоза в ротовой жидкости может иметь практическое клиническое применение в персонализированной диагностике предрасположенности к основным стоматологическим возраст-ассоциированным синдромам, а также системной сопутствующей патологии. Ранняя диагностика заболеваний на начальном этапе их развития позволяет давать пациентам своевременные рекомендации по коррекции повседневного образа жизни, привычек, приему препаратов.
Ключевые слова: старение, возраст-ассоциированные синдромы, молекулярные маркеры старения, полость рта.
АКТУАЛЬНОСТЬ
Старение – важный фактор развития различных заболеваний и функциональной недостаточности. Процесс старения является гетерогенным. Установлено, что скорость старения организма может существенно варьироваться в зависимости от образа жизни конкретного человека, условий среды, наследственных факторов и пр. Наибольший вклад в увеличение биологического возраста (8,41 года) вкладывают сочетание артериальной гипертензии, сахарного диабета и атеросклероза [1].
Маркеры старения помогают охарактеризовать этот процесс комплексно. В настоящее время не существует биомаркера старения, который можно было бы рассматривать в качестве золотого стандарта [2]. В доступной литературе не найдено маркера, полностью характеризующего данный процесс, максимально чувствительного и специфичного, позволяющего успешно мониторировать состояние организма. Вместе с этим определение биомаркеров старения необходимо для своевременной коррекции образа жизни человека и подбора наиболее адекватных методов лечения.
По мере исследования проблемы старения использовались различные критерии (маркеры).
Первыми из них были маркеры физических функций и антропометрии (Physical Function and Antropometry). К ним могут быть отнесены скорость ходьбы, способность к поддержанию равновесия, сила рукопожатия, индекс массы тела, обхват талии, мышечная масса и др. Данная группа признаков наиболее часто используется в популяционных исследованиях [2].
Длительное время наиболее широко используемыми были маркеры – показатели крови (Bloodbased markers). Среди них выделяют показатели метаболизма глюкозы (глюкоза крови, HbA1c), показатели липидного (холестерин, триглицериды, ЛПВП/ЛПНП), белкового (общий белок, альбумин, мочевина, креатинин), минерального обмена (Ca2+, Na+ , K+ ) [2].
В настоящее время наиболее перспективными являются молекулярные и генетические маркеры старения человека (Molecular/DNA-based markers) [2]. К молекулярным и генетическим маркерам относятся модификации ДНК (ДНК/хромосомные повреждения, восстановление ДНК, длина теломер) [3] и изменение степени экспрессии отдельных генов [4]. Молекулярные и генетические маркеры преимущественно характеризуют различные аспекты апоптоза. Апоптоз – процесс запрограммированной гибели клеток в отсутствии воспалительного ответа. Экспрессия некоторых генов может влиять на скорость и характер протекания апоптоза. Установлено, что ряд генов с возрастом экспрессируется чрезмерно, другие – недостаточно. Например, чрезмерно экспрессируемые с возрастом гены – IL-1A, Bcl2A1, CASP10, mTOR и др.; недостаточно экспрессируемые – TNF α, FAS, ATM, IGFR1 и др. [4, 5].
С точки зрения клинической медицины также можно выделить ряд признаков и нозологических форм, непосредственно связанных с увеличением возраста. В настоящее время к возраст-ассоциированным стоматологическим заболеваний относят повышенное стирание зубов (К0З.0), хронический пародонтит (К05.3), потерю зубов (К08.1), различные заболевания слизистой оболочки рта (нарушения секреции слюнных желез (К11.7), кандидозный стоматит (В37.0), лишай красный плоский (L43), лейкоплакия и другие изменения эпителия полости рта (К13.2)), а также доброкачественные новообразования рта и глотки (D10) и злокачественные новообразования губы, полости рта, глотки (С00 – С14) [6].
Отмеченные заболевания усугубляются тем, что практически у всех пациентов старших возрастных групп отмечается неудовлетворительная гигиена полости рта [6]. Плохое гигиеническое состояние рта у пожилых пациентов связано с когнитивными нарушениями (у пациентов в возрасте 60-74 лет распространенность когнитивных нарушений достигает 10,1%) [7], сенсорным дефицитом (нарушения зрения, слуха, тактильной чувствительности), ухудшением мелкой моторики и низкой мотивацией к осуществлению гигиены полости рта [7, 8].
Условно данные возраст-ассоциированные заболевания можно сгруппировать в клинические стоматологические синдромы (окклюзионный, пародонтальный, дистрофический).
Окклюзионный синдром
При внешнем осмотре определяется гипертрофия жевательных мышц, выраженные носогубные и подбородочная складки, уменьшение нижней трети лица. Ткани пародонта у таких пациентов без выраженных признаков воспаления, с преобладанием дистрофических процессов, отмечаются рецессии десен, подвижность зубов физиологическая. Твердые ткани зубов подвержены различным формам некариозных поражений: повышенной стираемости (attrition), клиновидным дефектам (abrasion) и абфракционным дефектам (аbfraction).
Пародонтальный синдром
При внешнем осмотре у пациентов с пародонтальным синдромом, как правило, отличительных особенностей не выявляется. Ткани пародонта гиперемированы, отечны, десны кровоточат при зондировании. Отмечаются глубокие пародонтальные карманы, рецессии десны, подвижность зубов I-III степени, неудовлетворительная гигиена полости рта. Слизистая оболочка рта также гиперемирована, отечна. Твердые ткани зубов без выраженных фасеток стираемости или имеют физиологическую стираемость, может отмечаться кариес корня [9, 10].
Дистрофический синдром
При внешнем осмотре у пациентов с дистрофическим синдромом могут выявляться признаки системной патологии (высыпания и др.). Слизистая оболочка рта у пациентов с дистрофическим синдромом истонченная, сухая, ранимая с различными видами патологии. Наиболее часто встречаются проявления красного плоского лишая (Lichen Planus) в полости рта, лихеноидные реакции (Oral Lichenoid Drug reaction) в результате длительного приема медикаментов (гипотензивные препараты, НПВС, карбамазепин, статины и др.), лихеноидные реакции (Oral lichenoid contact hypersensitivity stomatitis) вследствие контакта с конструкционными материалами (металлические части протезов, пломбы из амальгамы) [9, 10].
Цель работы – выявление взаимосвязи между клиническими стоматологическими возраст-ассоциированными синдромами и некоторыми предикторами старения в полости рта.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клинический раздел исследования выполнен на базе Стоматологической клиники ФГБОУ ВО УГМУ Минздрава России, лабораторный – в Отделе общей патологии Центральной научно-исследовательской лаборатории УГМУ.
В клиническом исследовании приняли участие 200 пациентов (111 женщин, 89 мужчин) пожилого (60-74 года) возраста в соответствии с классификацией ВОЗ. Пациенты были распределены на три группы в соответствии с клиническим стоматологическим синдромом, выявленным в результате стоматологического обследования. Исследуемая группа 1 включала пациентов с окклюзионным синдромом (63 человека), исследуемая группа 2 – с пародонтальным (79 человек), исследуемая группа 3 – с дистрофическим (58 человек). В 1-ю группу вошли пациенты с диагнозами «повышенная стираемость зубов» (К0З.0), «клиновидные дефекты» (К03.1); во 2-ю группу – с хроническим пародонтитом (К05.3); в 3-ю группу – с такими заболеваниями слизистой оболочки рта, как лишай красный плоский (L43), лейкоплакия и другие изменения эпителия полости рта (К13.2), кандидозный стоматит (В37.0), доброкачественные новообразования рта и глотки (D10) и злокачественные новообразования губы, полости рта, глотки (С00 – С14). Перед проведением исследования все пациенты оформляли информированное добровольное согласие. Научно-исследовательская работа одобрена локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России (протокол №3 от 19.03.2021 г.).
Стоматологическое обследование включало общеклинические (сбор анамнеза, осмотр) и рентгенологические (2D- и 3D-исследования) методы. Пациентам назначали биохимические исследования (биохимичский анализ крови) и консультации смежных специалистов.
Лабораторное исследование включало иммунологические методы (иммунохимическое исследование ротовой жидкости). Материалом исследования служила нестимулированная ротовая жидкость. Ротовую жидкость получали не ранее чем через 3 часа после приема пищи и полоскания полости рта, собирали в пробирки SalivaCapsSet. Пробирки маркировались, замораживались и хранились при температуре минус 20 °С. Перед исследованием биологический материал размораживался и центрифугировался в течение 10 минут при 1500 об/мин с использованием лабораторной центрифуги ЦЛМН-Р10-01 – «Элекон».
Иммунохимическое исследование ротовой жидкости включало определение Bcl-2 (B cell lymphoma 2), сaspase 3, сytochrome C, GAPDH (glyceraldehyde 3-phosphate dehydrogenase), сleaved PARP (poly (ADP-ribose) polymerase) и p53 методом мультипараметрического флуоресцентного анализа с магнитными микросферами (технология xMAP, Luminex 200, USA) с использованием тест-систем ProcartaPlex Apoptosis 6-Plex Human ProcartaPlex™ Panel и ProcartaPlex Human Cytokine/ Chemokine (Invitrogen, USA) согласно протоколу производителя. Концентрацию каждого аналита рассчитывали на основе средней интенсивности флуоресценции (MFI) частиц по калибровочному графику с помощью программного обеспечения xPONENT и ProcartaPlex.
Статистическая обработка результатов исследования проводилась на основании принципов вариационной статистики. С помощью критерия Колмогорова – Смирнова установили, что выборки имеют неправильное распределение, поэтому использовались непараметрические критерии. Результаты лабораторных исследований сравнивались при помощи критерия Манна – Уитни, данные представлены как медиана (Ме), 25-й; 75-й квартиль (Q1; Q3). Достоверность различий между группами оценивали по величине критерия Манна – Уитни.
Для статистической обработки данных применен классический дискриминантный анализ на базе программного пакета статистического анализа Statistica 9.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Научно доказано, что активация апоптоза осуществляется различными путями, включающими, в частности, трансмембранные рецепторы семейства рецепторов фактора некроза опухоли (ФНО, TNF). В результате инициируется целый каскад цистеиновых протеаз – каспаз, которые продолжают цепь событий, ведущих к завершению апоптоза (саморазрушению клетки). При этом центральную роль в регуляции апоптоза играют митохондрии и содержащийся в них цитохром С [11, 12]. Следовательно, определение активности каспазы-3 и содержания цитохрома отражают активность апоптоза. Именно поэтому данные ключевые показатели были оценены в ротовой жидкости у пациентов старших возрастных групп с различными синдромами (табл. 1).
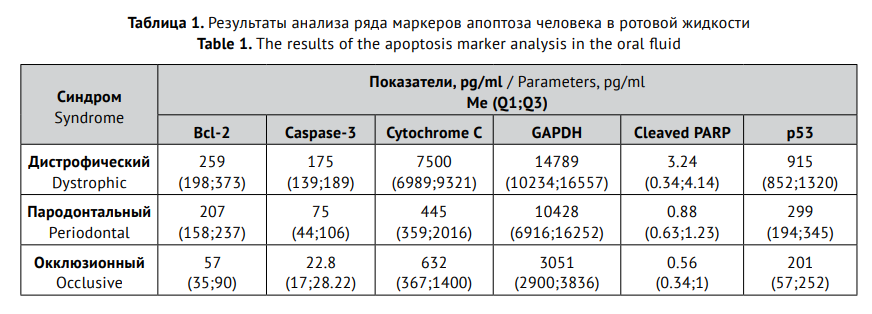
Приведенные данные свидетельствуют о том, что наиболее высокая концентрация маркеров апоптоза отмечается у пациентов с дистрофическим синдромом, наиболее низкая – при окклюзионном синдроме. Пародонтальный синдром сопровождается промежуточным уровнем предикторов старения.
ЗАКЛЮЧЕНИЕ
Таким образом, при иммунохимическом анализе ротовой жидкости пациентов с дистрофическим синдромом выявлены нарушения уровня апоптозрегулирующих белков и получены признаки активации апоптоза. Полученные данные позволяют предположить, что выраженное увеличение концентрации маркеров апоптоза у пациентов с дистрофическим синдромом влияет на состояние клеток эпителия, что клинически проявляется в атрофии слизистой оболочки рта, гипер- и паракератозе, воспалении.
Определение уровня маркеров апоптоза в ротовой жидкости может служить для оценки индивидуальных аспектов старения и может быть использовано:
СПИСОК ЛИТЕРАТУРЫ
1. Седов ЕВ, Линькова НС, Козлов КЛ, Кветная ТВ, Коновалов СС. Буккальный эпителий как объект оценки биологического возраста и темпа старения организма. Успехи геронтологии. 2013;26(4):610–613. Режим доступа: https://www.elibrary.ru/item.asp?id=21007588
2. Wagner KH, Cameron-Smith D, Wessner B, Franzke B. Biomarkers of Aging: From Function to Molecular Biology. Nutrients. 2016;8:338. doi: 10.3390/nu8060338
3. Jung SE, Lim SM, Hong SR, Lee EH, Shin KJ, Lee HY. DNA methylation of the ELOVL2, FHL2, KLF14, C1orf132/MIR29B2C, and TRIM59 genes for age prediction from blood, saliva, and buccal swab samples. Forensic Science International: Genetics. 2019;38:1-8. doi: 10.1016/j.fsigen.2018.09.010
4. Gonzalez OA, Novak MJ, Kirakodu S, Stromberg AJ, Shen S, Orraca L, Gonzalez-Martinez J, et al. Effects of aging on apoptosis gene expression in oral mucosal tissues. Apoptosis. 2013;18(3):249-259. doi: 10.1007/s10495-013-0806-x
5. Xia Y, Sun M, Xie Y, Shu R. mTOR Inhibition Rejuvenates the Aging Gingival Fibroblasts through Alleviating Oxidative Stress. Oxidative Medicine and Cellular Longevity. 2017, Article ID 6292630, 11 pages doi: 10.1155/2017/6292630
6. Putten van der GJ, de Baat C, De Visschere L, Schols J. Poor oral health, a potential new geriatric syndrome. Gerodontology. 2014;31(1):17-24. doi: 10.1111/ger.12086
7. Petersen RC, Lopez O, Armstrong MJ, Getchius TSD, Ganguli M, Gloss D, Gronseth GS et al. Practice guideline update summary: mild cognitive impairment. Neurology. 2018;90(3):126-135. doi: 10.1212/wnl.0000000000004826
8. Ильницкий А, Позднякова Н, Носкова И. Здоровое старение. Наука и инновации. 2016;66(12):18-21. Режим доступа: https://www.elibrary.ru/item.asp?id=27544196
9. Ramsay SE, Papachristou E, Watt RG, Tsakos G, Lennon LT, Papacosta AO, Moynihan P et al. Influence of Poor Oral Health on Physical Frailty: A PopulationBased Cohort Study of Older British Men. Journal of the American Geriatrics Society. 2018;66(3):473-479. doi: 10.1111/jgs.15175
10. An JY, Darveau R, Kaeberlein M. Oral health in geroscience: animal models and the aging oral cavity. GeroScience. 2018;40:1–10. doi: 10.1007/s11357-017-0004-9
11. Shalini S, Dorstyn L, Dawar S, Kumar S. Old, new and emerging functions of caspases. Cell Death & Differentiation. 2015;22(4):526-39. doi: 10.1038/cdd.2014.216
12. Tower J. Programmed cell death in aging. Ageing Research Reviews. 2015;23:90-100. doi: 10.1016/j.arr.2015.04.002
Актуальность. Старение – важный фактор развития различных заболеваний и функциональной недостаточности. Маркеры старения помогают охарактеризовать процесс старения комплексно. В настоящее время наиболее перспективными являются молекулярные и генетические маркеры старения человека (Molecular/DNA-based markers).
Цель исследования – выявление взаимосвязи между клиническими стоматологическими возраст-ассоциированными синдромами и некоторыми предикторами старения в полости рта.
Материалы и методы. В клиническом исследовании приняли участие 200 пациентов пожилого возраста (60-74 года) в соответствии с классификацией ВОЗ. Пациенты были распределены на три группы в зависимости от выявленного клинического стоматологического синдрома (окклюзионный, пародонтальный, дистрофический). У всех пациентов была получена нестимулированная ротовая жидкость. Иммунохимическое исследование ротовой жидкости включало определение Bcl-2 (B cell lymphoma 2), сaspase 3, сytochrome C, GAPDH (glyceraldehyde 3-phosphate dehydrogenase), сleaved PARP (poly (ADP-ribose) polymerase) и p53 методом мультипараметрического флуоресцентного анализа с магнитными микросферами.
Результаты. В результате проведения иммунохимического исследования ротовой жидкости пациентов было установлено, что наиболее высокая концентрация маркеров апоптоза отмечается у пациентов с дистрофическим синдромом, наиболее низкая – при окклюзионном синдроме. Пародонтальный синдром сопровождается промежуточным уровнем предикторов старения в ротовой жидкости.
Заключение. Определение уровня маркеров апоптоза в ротовой жидкости может иметь практическое клиническое применение в персонализированной диагностике предрасположенности к основным стоматологическим возраст-ассоциированным синдромам, а также системной сопутствующей патологии. Ранняя диагностика заболеваний на начальном этапе их развития позволяет давать пациентам своевременные рекомендации по коррекции повседневного образа жизни, привычек, приему препаратов.
Ключевые слова: старение, возраст-ассоциированные синдромы, молекулярные маркеры старения, полость рта.
АКТУАЛЬНОСТЬ
Старение – важный фактор развития различных заболеваний и функциональной недостаточности. Процесс старения является гетерогенным. Установлено, что скорость старения организма может существенно варьироваться в зависимости от образа жизни конкретного человека, условий среды, наследственных факторов и пр. Наибольший вклад в увеличение биологического возраста (8,41 года) вкладывают сочетание артериальной гипертензии, сахарного диабета и атеросклероза [1].
Маркеры старения помогают охарактеризовать этот процесс комплексно. В настоящее время не существует биомаркера старения, который можно было бы рассматривать в качестве золотого стандарта [2]. В доступной литературе не найдено маркера, полностью характеризующего данный процесс, максимально чувствительного и специфичного, позволяющего успешно мониторировать состояние организма. Вместе с этим определение биомаркеров старения необходимо для своевременной коррекции образа жизни человека и подбора наиболее адекватных методов лечения.
По мере исследования проблемы старения использовались различные критерии (маркеры).
Первыми из них были маркеры физических функций и антропометрии (Physical Function and Antropometry). К ним могут быть отнесены скорость ходьбы, способность к поддержанию равновесия, сила рукопожатия, индекс массы тела, обхват талии, мышечная масса и др. Данная группа признаков наиболее часто используется в популяционных исследованиях [2].
Длительное время наиболее широко используемыми были маркеры – показатели крови (Bloodbased markers). Среди них выделяют показатели метаболизма глюкозы (глюкоза крови, HbA1c), показатели липидного (холестерин, триглицериды, ЛПВП/ЛПНП), белкового (общий белок, альбумин, мочевина, креатинин), минерального обмена (Ca2+, Na+ , K+ ) [2].
В настоящее время наиболее перспективными являются молекулярные и генетические маркеры старения человека (Molecular/DNA-based markers) [2]. К молекулярным и генетическим маркерам относятся модификации ДНК (ДНК/хромосомные повреждения, восстановление ДНК, длина теломер) [3] и изменение степени экспрессии отдельных генов [4]. Молекулярные и генетические маркеры преимущественно характеризуют различные аспекты апоптоза. Апоптоз – процесс запрограммированной гибели клеток в отсутствии воспалительного ответа. Экспрессия некоторых генов может влиять на скорость и характер протекания апоптоза. Установлено, что ряд генов с возрастом экспрессируется чрезмерно, другие – недостаточно. Например, чрезмерно экспрессируемые с возрастом гены – IL-1A, Bcl2A1, CASP10, mTOR и др.; недостаточно экспрессируемые – TNF α, FAS, ATM, IGFR1 и др. [4, 5].
С точки зрения клинической медицины также можно выделить ряд признаков и нозологических форм, непосредственно связанных с увеличением возраста. В настоящее время к возраст-ассоциированным стоматологическим заболеваний относят повышенное стирание зубов (К0З.0), хронический пародонтит (К05.3), потерю зубов (К08.1), различные заболевания слизистой оболочки рта (нарушения секреции слюнных желез (К11.7), кандидозный стоматит (В37.0), лишай красный плоский (L43), лейкоплакия и другие изменения эпителия полости рта (К13.2)), а также доброкачественные новообразования рта и глотки (D10) и злокачественные новообразования губы, полости рта, глотки (С00 – С14) [6].
Отмеченные заболевания усугубляются тем, что практически у всех пациентов старших возрастных групп отмечается неудовлетворительная гигиена полости рта [6]. Плохое гигиеническое состояние рта у пожилых пациентов связано с когнитивными нарушениями (у пациентов в возрасте 60-74 лет распространенность когнитивных нарушений достигает 10,1%) [7], сенсорным дефицитом (нарушения зрения, слуха, тактильной чувствительности), ухудшением мелкой моторики и низкой мотивацией к осуществлению гигиены полости рта [7, 8].
Условно данные возраст-ассоциированные заболевания можно сгруппировать в клинические стоматологические синдромы (окклюзионный, пародонтальный, дистрофический).
Окклюзионный синдром
При внешнем осмотре определяется гипертрофия жевательных мышц, выраженные носогубные и подбородочная складки, уменьшение нижней трети лица. Ткани пародонта у таких пациентов без выраженных признаков воспаления, с преобладанием дистрофических процессов, отмечаются рецессии десен, подвижность зубов физиологическая. Твердые ткани зубов подвержены различным формам некариозных поражений: повышенной стираемости (attrition), клиновидным дефектам (abrasion) и абфракционным дефектам (аbfraction).
Пародонтальный синдром
При внешнем осмотре у пациентов с пародонтальным синдромом, как правило, отличительных особенностей не выявляется. Ткани пародонта гиперемированы, отечны, десны кровоточат при зондировании. Отмечаются глубокие пародонтальные карманы, рецессии десны, подвижность зубов I-III степени, неудовлетворительная гигиена полости рта. Слизистая оболочка рта также гиперемирована, отечна. Твердые ткани зубов без выраженных фасеток стираемости или имеют физиологическую стираемость, может отмечаться кариес корня [9, 10].
Дистрофический синдром
При внешнем осмотре у пациентов с дистрофическим синдромом могут выявляться признаки системной патологии (высыпания и др.). Слизистая оболочка рта у пациентов с дистрофическим синдромом истонченная, сухая, ранимая с различными видами патологии. Наиболее часто встречаются проявления красного плоского лишая (Lichen Planus) в полости рта, лихеноидные реакции (Oral Lichenoid Drug reaction) в результате длительного приема медикаментов (гипотензивные препараты, НПВС, карбамазепин, статины и др.), лихеноидные реакции (Oral lichenoid contact hypersensitivity stomatitis) вследствие контакта с конструкционными материалами (металлические части протезов, пломбы из амальгамы) [9, 10].
Цель работы – выявление взаимосвязи между клиническими стоматологическими возраст-ассоциированными синдромами и некоторыми предикторами старения в полости рта.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клинический раздел исследования выполнен на базе Стоматологической клиники ФГБОУ ВО УГМУ Минздрава России, лабораторный – в Отделе общей патологии Центральной научно-исследовательской лаборатории УГМУ.
В клиническом исследовании приняли участие 200 пациентов (111 женщин, 89 мужчин) пожилого (60-74 года) возраста в соответствии с классификацией ВОЗ. Пациенты были распределены на три группы в соответствии с клиническим стоматологическим синдромом, выявленным в результате стоматологического обследования. Исследуемая группа 1 включала пациентов с окклюзионным синдромом (63 человека), исследуемая группа 2 – с пародонтальным (79 человек), исследуемая группа 3 – с дистрофическим (58 человек). В 1-ю группу вошли пациенты с диагнозами «повышенная стираемость зубов» (К0З.0), «клиновидные дефекты» (К03.1); во 2-ю группу – с хроническим пародонтитом (К05.3); в 3-ю группу – с такими заболеваниями слизистой оболочки рта, как лишай красный плоский (L43), лейкоплакия и другие изменения эпителия полости рта (К13.2), кандидозный стоматит (В37.0), доброкачественные новообразования рта и глотки (D10) и злокачественные новообразования губы, полости рта, глотки (С00 – С14). Перед проведением исследования все пациенты оформляли информированное добровольное согласие. Научно-исследовательская работа одобрена локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России (протокол №3 от 19.03.2021 г.).
Стоматологическое обследование включало общеклинические (сбор анамнеза, осмотр) и рентгенологические (2D- и 3D-исследования) методы. Пациентам назначали биохимические исследования (биохимичский анализ крови) и консультации смежных специалистов.
Лабораторное исследование включало иммунологические методы (иммунохимическое исследование ротовой жидкости). Материалом исследования служила нестимулированная ротовая жидкость. Ротовую жидкость получали не ранее чем через 3 часа после приема пищи и полоскания полости рта, собирали в пробирки SalivaCapsSet. Пробирки маркировались, замораживались и хранились при температуре минус 20 °С. Перед исследованием биологический материал размораживался и центрифугировался в течение 10 минут при 1500 об/мин с использованием лабораторной центрифуги ЦЛМН-Р10-01 – «Элекон».
Иммунохимическое исследование ротовой жидкости включало определение Bcl-2 (B cell lymphoma 2), сaspase 3, сytochrome C, GAPDH (glyceraldehyde 3-phosphate dehydrogenase), сleaved PARP (poly (ADP-ribose) polymerase) и p53 методом мультипараметрического флуоресцентного анализа с магнитными микросферами (технология xMAP, Luminex 200, USA) с использованием тест-систем ProcartaPlex Apoptosis 6-Plex Human ProcartaPlex™ Panel и ProcartaPlex Human Cytokine/ Chemokine (Invitrogen, USA) согласно протоколу производителя. Концентрацию каждого аналита рассчитывали на основе средней интенсивности флуоресценции (MFI) частиц по калибровочному графику с помощью программного обеспечения xPONENT и ProcartaPlex.
Статистическая обработка результатов исследования проводилась на основании принципов вариационной статистики. С помощью критерия Колмогорова – Смирнова установили, что выборки имеют неправильное распределение, поэтому использовались непараметрические критерии. Результаты лабораторных исследований сравнивались при помощи критерия Манна – Уитни, данные представлены как медиана (Ме), 25-й; 75-й квартиль (Q1; Q3). Достоверность различий между группами оценивали по величине критерия Манна – Уитни.
Для статистической обработки данных применен классический дискриминантный анализ на базе программного пакета статистического анализа Statistica 9.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Научно доказано, что активация апоптоза осуществляется различными путями, включающими, в частности, трансмембранные рецепторы семейства рецепторов фактора некроза опухоли (ФНО, TNF). В результате инициируется целый каскад цистеиновых протеаз – каспаз, которые продолжают цепь событий, ведущих к завершению апоптоза (саморазрушению клетки). При этом центральную роль в регуляции апоптоза играют митохондрии и содержащийся в них цитохром С [11, 12]. Следовательно, определение активности каспазы-3 и содержания цитохрома отражают активность апоптоза. Именно поэтому данные ключевые показатели были оценены в ротовой жидкости у пациентов старших возрастных групп с различными синдромами (табл. 1).

Приведенные данные свидетельствуют о том, что наиболее высокая концентрация маркеров апоптоза отмечается у пациентов с дистрофическим синдромом, наиболее низкая – при окклюзионном синдроме. Пародонтальный синдром сопровождается промежуточным уровнем предикторов старения.
ЗАКЛЮЧЕНИЕ
Таким образом, при иммунохимическом анализе ротовой жидкости пациентов с дистрофическим синдромом выявлены нарушения уровня апоптозрегулирующих белков и получены признаки активации апоптоза. Полученные данные позволяют предположить, что выраженное увеличение концентрации маркеров апоптоза у пациентов с дистрофическим синдромом влияет на состояние клеток эпителия, что клинически проявляется в атрофии слизистой оболочки рта, гипер- и паракератозе, воспалении.
Определение уровня маркеров апоптоза в ротовой жидкости может служить для оценки индивидуальных аспектов старения и может быть использовано:
- для персонализированной диагностики предрасположенности к патологии слизистой оболочки рта, в частности, к предраковым состояниям и онкопатологии (маркер р53 и др.);
- для выявления предрасположенности к соматическим заболеваниям;
- для подготовки рекомендаций по коррекции повседневного образа жизни, привычек, приему препаратов.
СПИСОК ЛИТЕРАТУРЫ
1. Седов ЕВ, Линькова НС, Козлов КЛ, Кветная ТВ, Коновалов СС. Буккальный эпителий как объект оценки биологического возраста и темпа старения организма. Успехи геронтологии. 2013;26(4):610–613. Режим доступа: https://www.elibrary.ru/item.asp?id=21007588
2. Wagner KH, Cameron-Smith D, Wessner B, Franzke B. Biomarkers of Aging: From Function to Molecular Biology. Nutrients. 2016;8:338. doi: 10.3390/nu8060338
3. Jung SE, Lim SM, Hong SR, Lee EH, Shin KJ, Lee HY. DNA methylation of the ELOVL2, FHL2, KLF14, C1orf132/MIR29B2C, and TRIM59 genes for age prediction from blood, saliva, and buccal swab samples. Forensic Science International: Genetics. 2019;38:1-8. doi: 10.1016/j.fsigen.2018.09.010
4. Gonzalez OA, Novak MJ, Kirakodu S, Stromberg AJ, Shen S, Orraca L, Gonzalez-Martinez J, et al. Effects of aging on apoptosis gene expression in oral mucosal tissues. Apoptosis. 2013;18(3):249-259. doi: 10.1007/s10495-013-0806-x
5. Xia Y, Sun M, Xie Y, Shu R. mTOR Inhibition Rejuvenates the Aging Gingival Fibroblasts through Alleviating Oxidative Stress. Oxidative Medicine and Cellular Longevity. 2017, Article ID 6292630, 11 pages doi: 10.1155/2017/6292630
6. Putten van der GJ, de Baat C, De Visschere L, Schols J. Poor oral health, a potential new geriatric syndrome. Gerodontology. 2014;31(1):17-24. doi: 10.1111/ger.12086
7. Petersen RC, Lopez O, Armstrong MJ, Getchius TSD, Ganguli M, Gloss D, Gronseth GS et al. Practice guideline update summary: mild cognitive impairment. Neurology. 2018;90(3):126-135. doi: 10.1212/wnl.0000000000004826
8. Ильницкий А, Позднякова Н, Носкова И. Здоровое старение. Наука и инновации. 2016;66(12):18-21. Режим доступа: https://www.elibrary.ru/item.asp?id=27544196
9. Ramsay SE, Papachristou E, Watt RG, Tsakos G, Lennon LT, Papacosta AO, Moynihan P et al. Influence of Poor Oral Health on Physical Frailty: A PopulationBased Cohort Study of Older British Men. Journal of the American Geriatrics Society. 2018;66(3):473-479. doi: 10.1111/jgs.15175
10. An JY, Darveau R, Kaeberlein M. Oral health in geroscience: animal models and the aging oral cavity. GeroScience. 2018;40:1–10. doi: 10.1007/s11357-017-0004-9
11. Shalini S, Dorstyn L, Dawar S, Kumar S. Old, new and emerging functions of caspases. Cell Death & Differentiation. 2015;22(4):526-39. doi: 10.1038/cdd.2014.216
12. Tower J. Programmed cell death in aging. Ageing Research Reviews. 2015;23:90-100. doi: 10.1016/j.arr.2015.04.002
Характеристики
|
Автор книги
|
Е.А. Семенцова, Ю.В. Мандра, В.В. Базарный, Л.Г. Полушина, С.С. Григорьев, Т.М. Еловикова, Е.Н. Светлакова, Н.М. Жегалина |
|
Год выпуска
|
2022 |
Задать вопрос
Задать вопрос
Новости
Все новости
25 марта 2025
Образовательное кредитование: пособие для студентов СПО
20 октября 2023
Кредит на образование с господдержкой




 г. Москва, Ломоносовский проспект 29, корпус 2
г. Москва, Ломоносовский проспект 29, корпус 2
